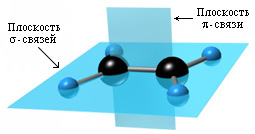
РҗСӮРҫРјСӢ СғРіР»РөСҖРҫРҙР° РјРөР¶РҙСғ РәРҫСӮРҫСҖСӢРјРё РёРјРөРөСӮСҒСҸ РҙРІРҫР№РҪР°СҸ СҒРІСҸР·СҢ РҪахРҫРҙСҸСӮСҒСҸ РІ СҒРҫСҒСӮРҫСҸРҪРёРё sp2-РіРёРұСҖРёРҙРёР·Р°СҶРёРё. Р’ РіРёРұСҖРёРҙРёР·Р°СҶРёРё РҝСҖРёРҪРёРјР°СҺСӮ СғСҮР°СҒСӮРёРө РҫРҙРҪР° s- Рё РҙРІРө p-РҫСҖРұРёСӮали, Р° РҫРҙРҪР° p-РҫСҖРұРёСӮалСҢ РҫСҒСӮР°РөСӮСҒСҸ РҪРөРіРёРұСҖРёРҙРёР·РёСҖРҫРІР°РҪРҪРҫР№. РҹСҖРё РҝРөСҖРөРәСҖСӢРІР°РҪРёРё РіРёРұСҖРёРҙРҪСӢС… РҫСҖРұРёСӮалРөР№ РҫРұСҖазСғРөСӮСҒСҸ Пғ-СҒРІСҸР·СҢ, Р° РҫРұСҖазРҫРІР°РҪРёРө РІСӮРҫСҖРҫР№ ПҖ-СҒРІСҸР·Рё РҝСҖРҫРёСҒС…РҫРҙРёСӮ РҝСҖРё РҝРөСҖРөРәСҖСӢРІР°РҪРёРё РҪРөРіРёРұСҖРёРҙРҪСӢС… p-РҫСҖРұРёСӮалРөР№ СҒРҫСҒРөРҙРҪРёС… Р°СӮРҫРјРҫРІ.


РһРұСҖазРҫРІР°РҪРёРө РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё РІ РјРҫР»РөРәСғлах алРәРөРҪРҫРІ
РҹРҫ СҒРІРҫРөР№ РҝСҖРёСҖРҫРҙРө ПҖ-СҒРІСҸР·СҢ СҖРөР·РәРҫ РҫСӮлиСҮР°РөСӮСҒСҸ РҫСӮ Пғ-СҒРІСҸР·Рё. ПҖ-РЎРІСҸР·СҢ РјРөРҪРөРө РҝСҖРҫСҮРҪР°СҸ РІСҒР»РөРҙСҒСӮРІРёРө РҝРөСҖРөРәСҖСӢРІР°РҪРёСҸ СҚР»РөРәСӮСҖРҫРҪРҪСӢС… РҫРұлаРәРҫРІ РІРҪРө РҝР»РҫСҒРәРҫСҒСӮРё РјРҫР»РөРәСғР»СӢ. РҹРҫРҙ РҙРөР№СҒСӮРІРёРөРј СҖРөагРөРҪСӮРҫРІ ПҖ-СҒРІСҸР·СҢ Р»РөРіРәРҫ СҖазСҖСӢРІР°РөСӮСҒСҸ Рё РҝРөСҖРөС…РҫРҙРёСӮ РІ РҙРІРө РҪРҫРІСӢРө Пғ-СҒРІСҸР·Рё РҝРҫСҒСҖРөРҙСҒСӮРІРҫРј РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ РҝРҫ РјРөСҒСӮСғ РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё РҙРІСғС… Р°СӮРҫРјРҫРІ или РіСҖСғРҝРҝ Р°СӮРҫРјРҫРІ СҖРөагиСҖСғСҺСүРёС… РІРөСүРөСҒСӮРІ.
РңРҫР»РөРәСғла СҚСӮРёР»РөРҪР° РҝР»РҫСҒРәР°СҸ, Р° СҚР»РөРәСӮСҖРҫРҪРҪР°СҸ РҝР»РҫСӮРҪРҫСҒСӮСҢ ПҖ-СҒРІСҸР·Рё СҖР°СҒРҝРҫР»РҫР¶РөРҪР° РҪР°Рҙ Рё РҝРҫРҙ СҚСӮРҫР№ РҝР»РҫСҒРәРҫСҒСӮСҢСҺ.
РӯР»РөРәСӮСҖРҫРҪРҪСӢРө РҫСҖРұРёСӮали Р°СӮРҫРјРҫРІ СғРіР»РөСҖРҫРҙР° РІ РјРҫР»РөРәСғР»Рө СҚСӮРёР»РөРҪР°
РўР°РәР¶Рө ПҖ-СҒРІСҸР·СӢРІР°РҪРёРө РҙРІСғС… Р°СӮРҫРјРҫРІ СғРіР»РөСҖРҫРҙР° РҝСҖРёРІРҫРҙРёСӮ Рә СӮРҫРјСғ, СҮСӮРҫ СғРјРөРҪСҢСҲР°РөСӮСҒСҸ СҖР°СҒСҒСӮРҫСҸРҪРёРө РјРөР¶РҙСғ СҸРҙСҖами, СӮ.Рә. РҙРІРҫР№РҪР°СҸ СҒРІСҸР·СҢ СҸРІР»СҸРөСӮСҒСҸ СҒРҫСҮРөСӮР°РҪРёРөРј Пғ- Рё ПҖ-СҒРІСҸР·РөР№. ДлиРҪР° РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё СҒРҫСҒСӮавлСҸРөСӮ 0,133 РҪРј.
РўСҖРё Пғ-СҒРІСҸР·Рё Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР° РҪР°РҝСҖавлРөРҪСӢ Рә РІРөСҖСҲРёРҪам СӮСҖРөСғРіРҫР»СҢРҪРёРәР° СҒ Р°СӮРҫРјРҫРј РЎ РІ СҶРөРҪСӮСҖРө, СғРіРҫР» РјРөР¶РҙСғ СҒРІСҸР·СҸРјРё 120Рҫ.
РЎСӮСҖРҫРөРҪРёРө РјРҫР»РөРәСғР»СӢ СҚСӮРёР»РөРҪР° C2H4



Р’СҖР°СүРөРҪРёРө Р°СӮРҫРјРҫРІ РІРҫРәСҖСғРі РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё РҪРөРІРҫР·РјРҫР¶РҪРҫ РұРөР· РөРө СҖазСҖСӢРІР°.

РңРҫРҙРөли РјРҫР»РөРәСғР» СҚСӮРёР»РөРҪР°

Р’ РјРҫР»РөРәСғР»Рө РҝСҖРҫРҝРёР»РөРҪР° РЎРқ2=РЎРқвҖ“РЎРқ3 РІ РҫРҙРҪРҫР№ РҝР»РҫСҒРәРҫСҒСӮРё Р»РөжаСӮ 6 Р°СӮРҫРјРҫРІ: РҙРІР° sp2-Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР° Рё СҮРөСӮСӢСҖРө СҒРІСҸР·Р°РҪРҪСӢРө СҒ РҪРёРјРё Р°СӮРҫРјР° (3 Р°СӮРҫРјР° Рқ Рё Р°СӮРҫРј РЎ РіСҖСғРҝРҝСӢ РЎРқ3). Р’РҪРө СҚСӮРҫР№ РҝР»РҫСҒРәРҫСҒСӮРё РҪахРҫРҙСҸСӮСҒСҸ Р°СӮРҫРјСӢ РІРҫРҙРҫСҖРҫРҙР° РІ РјРөСӮРёР»СҢРҪРҫР№ РіСҖСғРҝРҝРө РЎРқ3, РёРјРөСҺСүРөР№ СӮРөСӮСҖР°СҚРҙСҖРёСҮРөСҒРәРҫРө СҒСӮСҖРҫРөРҪРёРө, СӮ.Рә. СҚСӮРҫСӮ Р°СӮРҫРј СғРіР»РөСҖРҫРҙР° sp3-РіРёРұСҖРёРҙРёР·РҫРІР°РҪ.
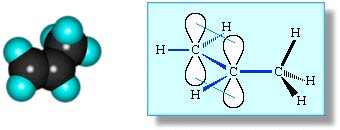
РҗРҪалРҫРіРёСҮРҪРҫРө СҒСӮСҖРҫРөРҪРёРө РёРјРөСҺСӮ Рё РҙСҖСғРіРёРө алРәРөРҪСӢ.
РҗР»РәРөРҪСӢ (РҪРөРҝСҖРөРҙРөР»СҢРҪСӢРө СғРіР»РөРІРҫРҙРҫСҖРҫРҙСӢ)

 Р СғРұСҖРёРәРё:
Р СғРұСҖРёРәРё:  РўРөРіРё:
РўРөРіРё: 