Р’ алРәРёРҪах Р°СӮРҫРјСӢ СғРіР»РөСҖРҫРҙР° РҝСҖРё СӮСҖРҫР№РҪРҫР№ СҒРІСҸР·Рё РҪахРҫРҙСҸСӮСҒСҸ РІ СӮСҖРөСӮСҢРөРј валРөРҪСӮРҪРҫРј СҒРҫСҒСӮРҫСҸРҪРёРё (sp-РіРёРұСҖРёРҙРёР·Р°СҶРёСҸ).
РӯСӮРҫ РҫР·РҪР°СҮР°РөСӮ, СҮСӮРҫ РәажРҙСӢР№ Р°СӮРҫРј СғРіР»РөСҖРҫРҙР° РҫРұлаРҙР°РөСӮ РҙРІСғРјСҸ РіРёРұСҖРёРҙРҪСӢРјРё sp-РҫСҖРұРёСӮалСҸРјРё,В РҫСҒРё РәРҫСӮРҫСҖСӢС… СҖР°СҒРҝРҫР»РҫР¶РөРҪСӢ РҪР° РҫРҙРҪРҫР№ лиРҪРёРё РҝРҫРҙ СғРіР»РҫРј 180В° РҙСҖСғРі Рә РҙСҖСғРіСғ, Р° РҙРІРө РҪРөРіРёРұСҖРёРҙРҪСӢС… СҖ-РҫСҖРұРёСӮали, СҖР°СҒРҝРҫР»РҫР¶РөРҪРҪСӢ РҝРҫРҙ СғРіР»РҫРј 90В° РҝРҫ РҫСӮРҪРҫСҲРөРҪРёСҺ РҙСҖСғРі Рә РҙСҖСғРіСғ Рё Рә sp-РіРёРұСҖРёРҙРҪСӢРј РҫСҖРұРёСӮалСҸРј:

Р Р°СҒРҝРҫР»РҫР¶РөРҪРёРө РҫСҖРұРёСӮалРөР№ Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР° РІ СҒРҫСҒСӮРҫСҸРҪРёРё sp-РіРёРұСҖРёРҙРёР·Р°СҶРёРё
РҹРҫ РҫРҙРҪРҫР№ РёР· РҙРІСғС… РіРёРұСҖРёРҙРҪСӢС… РҫСҖРұРёСӮалРөР№ РәажРҙРҫРіРҫ Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР° взаимРҪРҫ РҝРөСҖРөРәСҖСӢРІР°СҺСӮСҒСҸ, РҝСҖРёРІРҫРҙСҸ Рә РҫРұСҖазРҫРІР°РҪРёСҺ Пғ-СҒРІСҸР·Рё РјРөР¶РҙСғ Р°СӮРҫмами СғРіР»РөСҖРҫРҙР°. РҡажРҙР°СҸ РҫСҒСӮавСҲР°СҸСҒСҸ РіРёРұСҖРёРҙРҪР°СҸ РҫСҖРұРёСӮалСҢ РҝРөСҖРөРәСҖСӢРІР°РөСӮСҒСҸ СҒ s-РҫСҖРұРёСӮалСҢСҺ Р°СӮРҫРјР° РІРҫРҙРҫСҖРҫРҙР°, РҫРұСҖазСғСҸ Пғ-СҒРІСҸР·СҢ РЎвҖ“Рқ.

РЎС…РөРјР° РҫРұСҖазРҫРІР°РҪРёСҸ Пғ-СҒРІСҸР·РөР№ РІ РјРҫР»РөРәСғР»Рө Р°СҶРөСӮРёР»РөРҪР°В
Р§РөСӮСӢСҖРө РҪРөРіРёРұСҖРёРҙРҪСӢС… p-РҫСҖРұРёСӮали СҖазмРөСүРөРҪСӢ взаимРҪРҫ РҝРөСҖРҝРөРҪРҙРёРәСғР»СҸСҖРҪРҫ Рё РҝРөСҖРҝРөРҪРҙРёРәСғР»СҸСҖРҪРҫ РҪР°РҝСҖавлРөРҪРёСҸРј Пғ-СҒРІСҸР·РөР№. Р’ СҚСӮРёС… РҝР»РҫСҒРәРҫСҒСӮСҸС… p-РҫСҖРұРёСӮали взаимРҪРҫ РҝРөСҖРөРәСҖСӢРІР°СҺСӮСҒСҸ, Рё РҫРұСҖазСғСҺСӮСҒСҸ РҙРІРө ПҖ-СҒРІСҸР·Рё, РәРҫСӮРҫСҖСӢРө РҫСӮРҪРҫСҒРёСӮРөР»СҢРҪРҫ РҪРөРҝСҖРҫСҮРҪСӢРө Рё РІ С…РёРјРёСҮРөСҒРәРёС… СҖРөР°РәСҶРёСҸС… Р»РөРіРәРҫ СҖазСҖСӢРІР°СҺСӮСҒСҸ.
РўР°РәРёРј РҫРұСҖазРҫРј, СӮСҖРҫР№РҪР°СҸ СҒРІСҸР·СҢ С…Р°СҖР°РәСӮРөСҖРёР·СғРөСӮСҒСҸ СҒРҫСҮРөСӮР°РҪРёРөРј РҫРҙРҪРҫР№ Пғ- Рё РҙРІСғС… ПҖ-СҒРІСҸР·РөР№.

Р Р°СҒРҝРҫР»РҫР¶РөРҪРёРө ПҖ-СҒРІСҸР·РөР№ РІРҫ взаимРҪРҫ РҝРөСҖРҝРөРҪРҙРёРәСғР»СҸСҖРҪСӢС… РҝР»РҫСҒРәРҫСҒСӮСҸС…
СӮСҖРҫР№РҪР°СҸ СҒРІСҸР·СҢ РІ Р°СҶРөСӮРёР»РөРҪРө
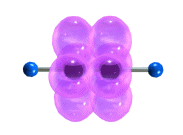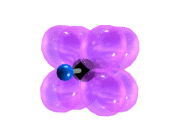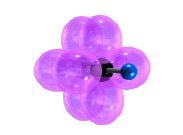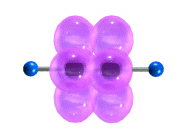
Р”РҫРҝРҫР»РҪРёСӮРөР»СҢРҪРҫРө СҒРІСҸР·СӢРІР°РҪРёРө РҙРІСғС… Р°СӮРҫРјРҫРІ СғРіР»РөСҖРҫРҙР° РҝСҖРёРІРҫРҙРёСӮ Рә СӮРҫРјСғ, СҮСӮРҫ СҖР°СҒСҒСӮРҫСҸРҪРёРө РјРөР¶РҙСғ СҸРҙСҖами СғРјРөРҪСҢСҲР°РөСӮСҒСҸ, РҝРҫСҒРәРҫР»СҢРәСғ СӮСҖРҫР№РҪР°СҸ СҒРІСҸР·СҢ СҸРІР»СҸРөСӮСҒСҸ СҒРҫСҮРөСӮР°РҪРёРөРј РҫРҙРҪРҫР№ Пғ- Рё РҙРІСғС… ПҖВӯ-СҒРІСҸР·РөР№. ДлиРҪР° СӮСҖРҫР№РҪРҫР№ СҒРІСҸР·Рё РЎвүЎРЎ СҒРҫСҒСӮавлСҸРөСӮ 0,120 РҪРј.
Пғ-CРІСҸР·Рё, РҫРұСҖазСғРөРјСӢРө spвҖ“РіРёРұСҖРёРҙРҪСӢРјРё РҫСҖРұРёСӮалСҸРјРё СғРіР»РөСҖРҫРҙР°, СҖР°СҒРҝРҫлагаСҺСӮСҒСҸ РҪР° РҫРҙРҪРҫР№ РҝСҖСҸРјРҫР№, РҝРҫСҚСӮРҫРјСғ РјРҫР»РөРәСғла Р°СҶРөСӮРёР»РөРҪР° РёРјРөРөСӮ лиРҪРөР№РҪРҫРө СҒСӮСҖРҫРөРҪРёРө:

РңРҫРҙРөли РјРҫР»РөРәСғР» Р°СҶРөСӮРёР»РөРҪР°
РҗР»РәРёРҪСӢВ (Р°СҶРөСӮРёР»РөРҪРҫРІСӢРө СғРіР»РөРІРҫРҙРҫСҖРҫРҙСӢ)

 Р СғРұСҖРёРәРё:
Р СғРұСҖРёРәРё:  РўРөРіРё:
РўРөРіРё: 