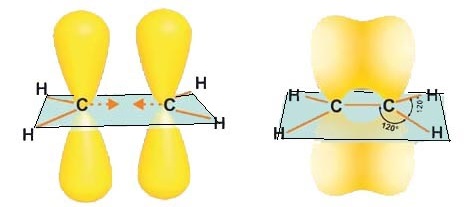
РҹСҖРёВ sСҖ2-РіРёРұСҖРёРҙРёР·Р°СҶРёРёРёВ СғСҮР°СҒСӮРІСғСҺСӮ РҫРҙРҪР° 2s- Рё РҙРІРө 2СҖ-РҫСҖРұРёСӮали, РҫРұСҖазСғСҸ СӮСҖРё sСҖ2-РіРёРұСҖРёРҙРҪСӢС… РҫРұлаРәР°. РӯСӮРё sСҖ2-РҫСҖРұРёСӮали СҖР°СҒРҝРҫР»РҫР¶РөРҪСӢ РІ РҫРҙРҪРҫР№ РҝР»РҫСҒРәРҫСҒСӮРё РҝРҫРҙ СғРіР»РҫРј 1200В РҙСҖСғРі Рә РҙСҖСғРіСғ Рё РҪР°РҝСҖавлРөРҪСӢ Рә РІРөСҖСҲРёРҪам СӮСҖРөСғРіРҫР»СҢРҪРёРәР°.

РһСҖРұРёСӮалСҢРҪР°СҸ РјРҫРҙРөР»СҢ Р°СӮРҫРјР° РІВ sp2-РіРёРұСҖРёРҙРёР·РҫРІР°РҪРҪРҫРј СҒРҫСҒСӮРҫСҸРҪРёРё

РһРұСҖазРҫРІР°РҪРёРө СӮСҖРөС… sСҖ2Вӯ-РіРёРұСҖРёРҙРҪСӢС… РҫСҖРұРёСӮалРөР№
Р’ РҪРөРҝСҖРөРҙРөР»СҢРҪСӢС… СғРіР»РөРІРҫРҙРҫСҖРҫРҙах СҖСҸРҙР° СҚСӮРёР»РөРҪР° РҙРІР° Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР°, РҪахРҫРҙСҸСүРёРөСҒСҸ РІ СҒРҫСҒСӮРҫСҸРҪРёРёВ sСҖ2-РіРёРұСҖРёРҙРёР·Р°СҶРёРё СҒСӮРҫСҸСӮ РІСҒРөРіРҙР° СҖСҸРҙРҫРј. РңРөР¶РҙСғ РҪРёРјРё Р·Р° СҒСҮРөСӮ РҫРұСӢСҮРҪРҫРіРҫ лиРҪРөР№РҪРҫРіРҫ РҝРөСҖРөРәСҖСӢРІР°РҪРёСҸ sСҖ2-РіРёРұСҖРёРҙРҪСӢС… РҫСҖРұРёСӮалРөР№ РІРҫР·РҪРёРәР°РөСӮ РәРҫвалРөРҪСӮРҪР°СҸ СҒРІСҸР·СҢ (Пғ-СҒРІСҸР·СҢ).
РһРҙРҪР° pВӯ-РҫСҖРұРёСӮалСҢ РҫСҒСӮР°РөСӮСҒСҸ РҪРөРіРёРұСҖРёРҙРёР·РҫРІР°РҪРҪРҫР№ Рё СҖР°СҒРҝРҫлагаРөСӮСҒСҸ РҝРөСҖРҝРөРҪРҙРёРәСғР»СҸСҖРҪРҫ РҝР»РҫСҒРәРҫСҒСӮРё sСҖвҖ“РіРёРұСҖРёРҙРҪСӢС… РҫСҖРұРёСӮалРөР№. Р’РөСҖС…РҪСҸСҸ РҝРҫР»РҫРІРёРҪа СҖ-РҫСҖРұРёСӮали РҪахРҫРҙРёСӮСҒСҸ РҪР°Рҙ РҝР»РҫСҒРәРҫСҒСӮСҢСҺ, РҪРёР¶РҪСҸСҸ РҝРҫР»РҫРІРёРҪР° вҖ“ РҝРҫРҙ РҝР»РҫСҒРәРҫСҒСӮСҢСҺ.
Р’СӮРҫСҖР°СҸ СҒРІСҸР·СҢ СӮР°РәР¶Рө РҫРұСҖазСғРөСӮСҒСҸ РјРөР¶РҙСғ РҙРІСғРјСҸ СғРіР»РөСҖРҫРҙРҪСӢРјРё Р°СӮРҫмами. РЎРІСҸР·СҢ РҫРұСҖазСғРөСӮСҒСҸ РІ СҖРөР·СғР»СҢСӮР°СӮРө РұРҫРәРҫРІРҫРіРҫ РҝРөСҖРөРәСҖСӢРІР°РҪРёСҸ РәСҖР°РөРІ РҪРөРіРёРұСҖРёРҙРёР·РҫРІР°РҪРҪСӢС… 2СҖВӯРҫСҖРұРёСӮалРөР№ Рё РҪазСӢРІР°РөСӮСҒСҸ ПҖВӯ-СҒРІСҸР·СҢСҺ.
РҹРөСҖРөРәСҖСӢРІР°РҪРёРө РҪРөРіРёРұСҖРёРҙРёР·РҫРІР°РҪРҪСӢС… 2СҖ-ВӯРҫСҖРұРёСӮалРөР№

РһРұСҖазРҫРІР°РҪРёРө СҒРёРіРјР°- Рё РҝРё-СҒРІСҸР·РөР№ РІ РјРҫР»РөРәСғР»Рө СҚСӮРёР»РөРҪР°
РһСҒСӮавСҲРёРөСҒСҸ РҙРІРө sСҖ2-РҫСҖРұРёСӮали Сғ РәажРҙРҫРіРҫ СғРіР»РөСҖРҫРҙРҪРҫРіРҫ Р°СӮРҫРјР° РёСҒРҝРҫР»СҢР·СғСҺСӮСҒСҸ РҙР»СҸ РҫРұСҖазРҫРІР°РҪРёСҸ ПғвҖ“СҒРІСҸР·РөР№ СҒ Р°СӮРҫмами РІРҫРҙРҫСҖРҫРҙР°.

РһРұСҖазРҫРІР°РҪРёРө РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё РІ РјРҫР»РөРәСғР»Рө СҚСӮРёР»РөРҪР°

РңРҫРҙРөР»СҢ РјРҫР»РөРәСғР»СӢ СҚСӮРёР»РөРҪР°В
РўРёРҝСӢ РіРёРұСҖРёРҙРёР·Р°СҶРёРё Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР°

 Р СғРұСҖРёРәРё:
Р СғРұСҖРёРәРё:  РўРөРіРё:
РўРөРіРё: 