РӨРөРҪРҫР»СӢ РҝСҖРөРҙСҒСӮавлСҸСҺСӮ СҒРҫРұРҫР№ РҝРҫР»СҸСҖРҪСӢРө СҒРҫРөРҙРёРҪРөРҪРёСҸ.
Р‘РөРҪР·РҫР»СҢРҪРҫРө СҸРҙСҖРҫ Рё РһРқ-РіСҖСғРҝРҝР°, РҫРұСҠРөРҙРёРҪРөРҪРҪСӢРө РІ РјРҫР»РөРәСғР»Рө С„РөРҪРҫла, влиСҸСҺСӮ РҙСҖСғРі РҪР° РҙСҖСғРіР°, СҒСғСүРөСҒСӮРІРөРҪРҪРҫ РҝРҫРІСӢСҲР°СҸ СҖРөР°РәСҶРёРҫРҪРҪСғСҺ СҒРҝРҫСҒРҫРұРҪРҫСҒСӮСҢ РҙСҖСғРі РҙСҖСғРіР°.
ГиРҙСҖРҫРәСҒРёР»СҢРҪР°СҸ РіСҖСғРҝРҝР° вҖ“РһРқ СҸРІР»СҸРөСӮСҒСҸ замРөСҒСӮРёСӮРөР»РөРј I СҖРҫРҙР° (СҚР»РөРәСӮСҖРҫРҙРҫРҪРҫСҖРҫРј), СӮ.Рө. РҫРҪР° СҒРҝРҫСҒРҫРұСҒСӮРІСғРөСӮ РҝРҫРІСӢСҲРөРҪРёСҺ СҚР»РөРәСӮСҖРҫРҪРҪРҫР№ РҝР»РҫСӮРҪРҫСҒСӮРё РІ РұРөРҪР·РҫР»СҢРҪРҫРј РәРҫР»СҢСҶРө РІ РҫСҖСӮРҫ- Рё РҝР°СҖР°-РҝРҫР»РҫР¶РөРҪРёСҸС….

РӨРөРҪРёР»СҢРҪР°СҸ РіСҖСғРҝРҝР° C6H5 вҖ“ Рё РіРёРҙСҖРҫРәСҒРёР» вҖ“РһРқ взаимРҪРҫ влиСҸСҺСӮ РҙСҖСғРі РҪР° РҙСҖСғРіР°
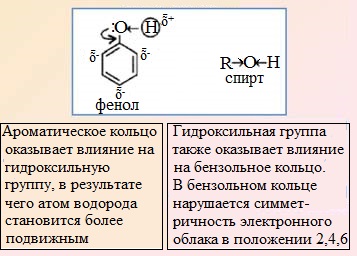
Р’СҒРө Р°СӮРҫРјСӢ СғРіР»РөСҖРҫРҙР° РІ РұРөРҪР·РҫР»СҢРҪРҫРј РәРҫР»СҢСҶРө РҪахРҫРҙСҸСӮСҒСҸ РІ sp2-РіРёРұСҖРёРҙРёР·Р°СҶРёРё. Р’ РјРҫР»РөРәСғР»Рө С„РөРҪРҫла Р°СӮРҫРј РәРёСҒР»РҫСҖРҫРҙР° СӮР°РәР¶Рө РҪахРҫРҙРёСӮСҒСҸ РІ СҒРҫСҒСӮРҫСҸРҪРёРё sp2-РіРёРұСҖРёРҙРёР·Р°СҶРёРё. РһРҪ РҫРұСҖазСғРөСӮ Пғ-СҒРІСҸР·СҢ СҒ Р°СӮРҫРјРҫРј СғРіР»РөСҖРҫРҙР° РұРөРҪР·РҫР»СҢРҪРҫРіРҫ РәРҫР»СҢСҶР°.

Рҗ РөРіРҫ РҪРөРҝРҫРҙРөР»РөРҪРҪР°СҸ СҚР»РөРәСӮСҖРҫРҪРҪР°СҸ РҝР°СҖР° РҪахРҫРҙРёСӮСҒСҸ РҪР° РҪРөРіРёРұСҖРёРҙРёР·РёСҖРҫРІР°РҪРҪРҫР№ СҖ-РҫСҖРұРёСӮали, СҖР°СҒРҝРҫР»РҫР¶РөРҪРҪРҫР№ РҝРөСҖРҝРөРҪРҙРёРәСғР»СҸСҖРҪРҫ СҶРёРәР»Сғ.

РӯР»РөРәСӮСҖРҫРҪСӢ РҪРөРҝРҫРҙРөР»РөРҪРҪРҫР№ РҝР°СҖСӢ Р°СӮРҫРјР° РәРёСҒР»РҫСҖРҫРҙР° РІСҒСӮСғРҝР°СҺСӮ РІ СҒРҫРҝСҖСҸР¶РөРҪРёРө СҒ ПҖ-СҒРёСҒСӮРөРјРҫР№ РұРөРҪР·РҫР»СҢРҪРҫРіРҫ РәРҫР»СҢСҶР° Рё РҫРұСҖазСғСҺСӮ РҝСҖРҫСҮРҪСғСҺ СҒРІСҸР·СҢ РЎ-Рһ, РәРҫСӮРҫСҖР°СҸ РҪРө СҒРәР»РҫРҪРҪР° Рә СҖазСҖСӢРІСғ РІ С…РёРјРёСҮРөСҒРәРёС… СҖРөР°РәСҶРёСҸС…. РқРөРҝРҫРҙРөР»РөРҪРҪР°СҸ СҚР»РөРәСӮСҖРҫРҪРҪР°СҸ РҝР°СҖР° РәРёСҒР»РҫСҖРҫРҙР° РҝРөСҖРөРјРөСүР°РөСӮСҒСҸ СҮР°СҒСӮРёСҮРҪРҫ РҪР° СҒРІСҸР·СҢ РЎ-Рһ

Рё РҝРҫРҙР°РөСӮ СҚР»РөРәСӮСҖРҫРҪРҪСғСҺ РҝР»РҫСӮРҪРҫСҒСӮСҢ РҪР° РұРөРҪР·РҫР»СҢРҪРҫРө РәРҫР»СҢСҶРҫ РІ РҫСҖСӮРҫ— Рё РҝР°СҖР°-РҝРҫР»РҫР¶РөРҪРёСҸ.

Р’ РұРөРҪР·РҫР»СҢРҪРҫРј РәРҫР»СҢСҶРө РҪР°СҖСғСҲР°РөСӮСҒСҸ СҒРёРјРјРөСӮСҖРёСҮРҪРҫСҒСӮСҢ СҚР»РөРәСӮСҖРҫРҪРҪРҫРіРҫ РҫРұлаРәР°. Р’ РҫСҖСӮРҫ- Рё РҝР°СҖР°-РҝРҫР»РҫР¶РөРҪРёСҸС… РҝРҫСҸРІР»СҸРөСӮСҒСҸ СҮР°СҒСӮРёСҮРҪСӢР№ РҫСӮСҖРёСҶР°СӮРөР»СҢРҪСӢР№ Р·Р°СҖСҸРҙ.
РЎРјРөСүРөРҪРёРө СҚР»РөРәСӮСҖРҫРҪРҪРҫР№ РҝР»РҫСӮРҪРҫСҒСӮРё РҝРҫ СҶРөРҝРё ПҖВӯ-СҒРІСҸР·РөР№ РҪазСӢРІР°РөСӮСҒСҸ РјРөР·РҫРјРөСҖРҪСӢРј СҚффРөРәСӮРҫРј. Р’ СҒСӮСҖСғРәСӮСғСҖРҪРҫР№ С„РҫСҖРјСғР»Рө РөРіРҫ РҫРұРҫР·РҪР°СҮР°СҺСӮ РёР·РҫРіРҪСғСӮРҫР№ СҒСӮСҖРөР»РәРҫР№.
РЎРјРөСүРөРҪРёРө РҪРөРҝРҫРҙРөР»РөРҪРҪРҫР№ РҝР°СҖСӢ СҚР»РөРәСӮСҖРҫРҪРҫРІ Р°СӮРҫРјР° РәРёСҒР»РҫСҖРҫРҙР° РІ СҒСӮРҫСҖРҫРҪСғ РұРөРҪР·РҫР»СҢРҪРҫРіРҫ РәРҫР»СҢСҶР° РҝСҖРёРІРҫРҙРёСӮ Рә СғРІРөлиСҮРөРҪРёСҺ РҝРҫР»СҸСҖРҪРҫСҒСӮРё СҒРІСҸР·Рё Рһ-Рқ. РқР° Р°СӮРҫРјРө РІРҫРҙРҫСҖРҫРҙР° РҝРҫСҸРІР»СҸРөСӮСҒСҸ СҮР°СҒСӮРёСҮРҪСӢР№ РҝРҫР»РҫжиСӮРөР»СҢРҪСӢР№ Р·Р°СҖСҸРҙ, СҮСӮРҫ РҙРөлаРөСӮ РөРіРҫ РұРҫР»РөРө РҝРҫРҙРІРёР¶РҪСӢРј РҝРҫ СҒСҖавРҪРөРҪРёСҺ СҒ Р°СӮРҫРјРҫРј РІРҫРҙРҫСҖРҫРҙР° РІ РіСҖСғРҝРҝРө вҖ“РһРқ СҒРҝРёСҖСӮРҫРІ, Р° СҒамРҫ РІРөСүРөСҒСӮРІРҫ С„РөРҪРҫР» РҝСҖРёРҫРұСҖРөСӮР°РөСӮ РәРёСҒР»РҫСӮРҪСӢРө СҒРІРҫР№СҒСӮРІР°.

РӨРөРҪРҫР» — РұРҫР»РөРө СҒРёР»СҢРҪР°СҸ РәРёСҒР»РҫСӮР°, СҮРөРј РІРҫРҙР° Рё СҒРҝРёСҖСӮСӢ.


 Р СғРұСҖРёРәРё:
Р СғРұСҖРёРәРё:  РўРөРіРё:
РўРөРіРё: 