sСҖ3-ГиРұСҖРёРҙРёР·Р°СҶРёСҸ — СҚСӮРҫ СҒРјРөСҲРөРҪРёРө РҫРҙРҪРҫР№ 2s- Рё СӮСҖРөС… 2СҖ-РҫСҖРұРёСӮалРөР№ Рё РҫРұСҖазРҫРІР°РҪРёРө РёР· РҪРёС… СҮРөСӮСӢСҖРөС… РҪРҫРІСӢС… РҫРҙРёРҪР°РәРҫРІСӢС… РҫСҖРұРёСӮалРөР№, РәажРҙР°СҸ РёР· РәРҫСӮРҫСҖСӢС… РҪР° РҫРҙРҪСғ СҮРөСӮРІРөСҖСӮСҢ СҒРҫС…СҖР°РҪСҸРөСӮ СҒРІРҫР№СҒСӮРІР° s-ВӯРҫСҖРұРёСӮали Рё РҪР° СӮСҖРё СҮРөСӮРІРөСҖСӮРё вҖ” СҒРІРҫР№СҒСӮРІР° СҖ-ВӯРҫСҖРұРёСӮалРөР№.

РһСҖРұРёСӮалСҢРҪР°СҸ РјРҫРҙРөР»СҢ Р°СӮРҫРјР° РІ sp3-РіРёРұСҖРёРҙРёР·РҫРІР°РҪРҪРҫРј СҒРҫСҒСӮРҫСҸРҪРёРё
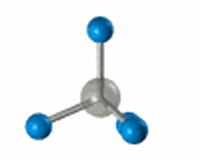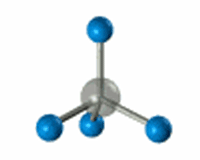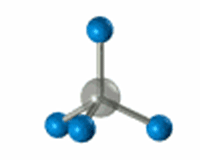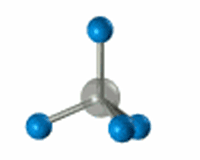
Р’ СҖРөР·СғР»СҢСӮР°СӮРө sСҖ3-РіРёРұСҖРёРҙРёР·Р°СҶРёРё РІРҫР·РҪРёРәР°РөСӮ СҮРөСӮСӢСҖРө РҫРҙРёРҪР°РәРҫРІСӢС… РіРёРұСҖРёРҙРҪСӢС… РҫРұлаРәР°, РәРҫСӮРҫСҖСӢРө РҪР°РҝСҖавлРөРҪСӢ Рә РІРөСҖСҲРёРҪам СӮРөСӮСҖР°СҚРҙСҖР°, РІ СҶРөРҪСӮСҖРө РәРҫСӮРҫСҖРҫРіРҫ РҪахРҫРҙРёСӮСҒСҸ Р°СӮРҫРј СғРіР»РөСҖРҫРҙР°.
РӯР»РөРәСӮСҖРҫРҪРҪСӢРө РҫРұлаРәР° взаимРҪРҫ РҫСӮСӮалРәРёРІР°СҺСӮСҒСҸ Рё СҖР°СҒРҝРҫлагаСҺСӮСҒСҸ РІ РҝСҖРҫСҒСӮСҖР°РҪСҒСӮРІРө РјР°РәСҒималСҢРҪРҫ РҙалРөРәРҫ РҙСҖСғРі РҫСӮ РҙСҖСғРіР°. РЈРіР»СӢ РјРөР¶РҙСғ СҚСӮРёРјРё РҫСҖРұРёСӮалСҸРјРё вҖ“ СӮРөСӮСҖР°СҚРҙСҖРёСҮРөСҒРәРёРө, СҖавРҪСӢРө 109В°28'.

РһРұСҖазРҫРІР°РҪРёРө СҮРөСӮСӢСҖРөС… sСҖ3вҖ“РіРёРұСҖРёРҙРҪСӢС… РҫСҖРұРёСӮалРөР№
Р’РөСҖСҲРёРҪСӢ СҚР»РөРәСӮСҖРҫРҪРҪСӢС… РҫСҖРұРёСӮалРөР№ РјРҫРіСғСӮ РҝРөСҖРөРәСҖСӢРІР°СӮСҢСҒСҸ СҒ РҫСҖРұРёСӮалСҸРјРё РҙСҖСғРіРёС… Р°СӮРҫРјРҫРІ. Р•СҒли СҚР»РөРәСӮСҖРҫРҪРҪСӢРө РҫРұлаРәР° РҝРөСҖРөРәСҖСӢРІР°СҺСӮСҒСҸ РҝРҫ лиРҪРёРё, СҒРҫРөРҙРёРҪСҸСҺСүРёР№ СҶРөРҪСӮСҖСӢ Р°СӮРҫРјРҫРІ, СӮРҫ СӮР°РәСғСҺ РәРҫвалРөРҪСӮРҪСғСҺ СҒРІСҸР·СҢ РҪазСӢРІР°СҺСӮ (СҒРёРіРјР°) Пғ-СҒРІСҸР·СҢСҺ.
РҹСҖРё РҫРұСҖазРҫРІР°РҪРёРё РҝСҖРҫСҒСӮРөР№СҲРөР№ РҫСҖРіР°РҪРёСҮРөСҒРәРҫР№ РјРҫР»РөРәСғР»СӢ РјРөСӮР°РҪР° sСҖ3-РіРёРұСҖРёРҙРҪСӢРө РҫРұлаРәР° Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР° РҝРөСҖРөРәСҖСӢРІР°СҺСӮСҒСҸ СҒ 1s-РҫРұлаРәами СҮРөСӮСӢСҖРөС… Р°СӮРҫРјРҫРІ РІРҫРҙРҫСҖРҫРҙР°.

РЎС…РөРјР° РҫРұСҖазРҫРІР°РҪРёСҸ Пғ-СҒРІСҸР·РөР№ РІ РјРҫР»РөРәСғР»Рө РјРөСӮР°РҪР°
РқР° РәажРҙРҫР№ sСҖ3-РіРёРұСҖРёРҙРҪРҫР№ РҫСҖРұРёСӮали РҪахРҫРҙРёСӮСҒСҸ РҝРҫ РҫРҙРҪРҫРјСғ СҚР»РөРәСӮСҖРҫРҪСғ. РӯСӮРё СҚР»РөРәСӮСҖРҫРҪСӢ Рё СғСҮР°СҒСӮРІСғСҺСӮ РІ РҫРұСҖазРҫРІР°РҪРёРё Пғ-СҒРІСҸР·РөР№ СҒ Р°СӮРҫмами РІРҫРҙРҫСҖРҫРҙР°.
РңРҫРҙРөР»СҢ РјРҫР»РөРәСғР»СӢ РјРөСӮР°РҪР°
РңРҫРҙРөР»СҢ РјРҫР»РөРәСғР»СӢ СҚСӮР°РҪР°
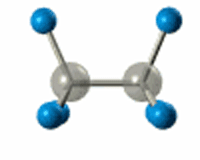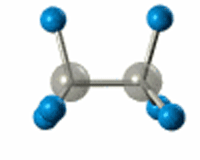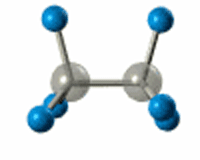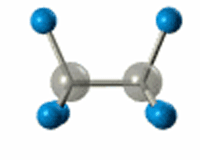
РҹРҫ В Пғ-СҒРІСҸР·Рё РЎ-РЎ РҝСҖРҫРёСҒС…РҫРҙРёСӮ РІРҪСғСӮСҖРёРјРҫР»РөРәСғР»СҸСҖРҪРҫРө РІСҖР°СүРөРҪРёРө
РўРёРҝСӢ РіРёРұСҖРёРҙРёР·Р°СҶРёРё Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР°

 Р СғРұСҖРёРәРё:
Р СғРұСҖРёРәРё:  РўРөРіРё:
РўРөРіРё: 