РҗР»РәРөРҪСӢ РҫРұлаРҙР°СҺСӮ РұРҫР»СҢСҲРҫР№ СҖРөР°РәСҶРёРҫРҪРҪРҫР№ СҒРҝРҫСҒРҫРұРҪРҫСҒСӮСҢСҺ, СҮРөРј алРәР°РҪСӢ. РӯСӮРҫ РҫРұСғСҒР»РҫРІР»РөРҪРҫ РҪалиСҮРёРөРј РІ РёС… РјРҫР»РөРәСғлах РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё. ПҖвҖ“РЎРІСҸР·СҢ РјРөРҪРөРө РҝСҖРҫСҮРҪР°СҸ, СҮРөРј Пғ-СҒРІСҸР·СҢ. РһРҪР° Р»РөРіРәРҫ СҖазСҖСғСҲР°РөСӮСҒСҸ РҝРҫРҙ РІРҫР·РҙРөР№СҒСӮРІРёРөРј СҖазлиСҮРҪСӢС… СҖРөагРөРҪСӮРҫРІ.
РқалиСҮРёРө РҝРҫРҙРІРёР¶РҪРҫР№, Р»РөРіРәРҫ РҝРҫР»СҸСҖРёР·СғРөРјРҫР№ ПҖвҖ“СҒРІСҸР·Рё РҝСҖРёРІРҫРҙРёСӮ Рә СӮРҫРјСғ, СҮСӮРҫ алРәРөРҪСӢ Р»РөРіРәРҫ РІСҒСӮСғРҝР°СҺСӮ РІ СҖРөР°РәСҶРёРё РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ.
Р’ СҖРөР°РәСҶРёСҸС… РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ РҙРІРҫР№РҪР°СҸ СҒРІСҸР·СҢ РІСӢСҒСӮСғРҝР°РөСӮ РәР°Рә РҙРҫРҪРҫСҖ СҚР»РөРәСӮСҖРҫРҪРҫРІ, РҝРҫСҚСӮРҫРјСғ РҙР»СҸ алРәРөРҪРҫРІ С…Р°СҖР°РәСӮРөСҖРҪСӢ СҖРөР°РәСҶРёРё СҚР»РөРәСӮСҖРҫфилСҢРҪРҫРіРҫ РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ.
Р РөР°РәСҶРёРё РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ

1. ГиРҙСҖРёСҖРҫРІР°РҪРёРө или РіРёРҙСҖРҫРіРөРҪРёР·Р°СҶРёСҸ (РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө РІРҫРҙРҫСҖРҫРҙР°)
РӯСӮР° СҖРөР°РәСҶРёСҸ РҝСҖРҫСӮРөРәР°РөСӮ РІ РҝСҖРёСҒСғСӮСҒСӮРІРёРё РәР°СӮализаСӮРҫСҖР° вҖ“ РјРөР»РәРҫ СҖазРҙСҖРҫРұР»РөРҪРҪРҫРіРҫ РҪРёРәРөР»СҸ, РҝлаСӮРёРҪСӢ или РҝаллаРҙРёСҸ РҝСҖРё РҪагСҖРөРІР°РҪРёРё Рё РҝРҫРІСӢСҲРөРҪРҪРҫРј РҙавлРөРҪРёРё.

РҹСҖРё РіРёРҙСҖРҫРіРөРҪРёР·Р°СҶРёРё РҫР»РөфиРҪСӢ РҝСҖРөРІСҖР°СүР°СҺСӮСҒСҸ РІ РҝСҖРөРҙРөР»СҢРҪСӢРө СғРіР»РөРІРҫРҙРҫСҖРҫРҙСӢ.
2. ГалРҫРіРөРҪРёСҖРҫРІР°РҪРёРө (РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө галРҫРіРөРҪРҫРІ)
РҹСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө галРҫРіРөРҪРҫРІ РҝРҫ РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё РЎ=РЎ РҝСҖРҫРёСҒС…РҫРҙРёСӮ Р»РөРіРәРҫ РҝСҖРё РҫРұСӢСҮРҪСӢС… СғСҒР»РҫРІРёСҸС… (РҝСҖРё РәРҫРјРҪР°СӮРҪРҫР№ СӮРөРјРҝРөСҖР°СӮСғСҖРө, РұРөР· РәР°СӮализаСӮРҫСҖР°). РһРұСҖазСғСҺСӮСҒСҸ РҙигалРҫРіРөРҪалРәР°РҪСӢ:


Р РөР°РәСҶРёСҸ СҒ РұСҖРҫРјРҪРҫР№ РІРҫРҙРҫР№ (СҖ-СҖ Br2 РІ Рқ2Рһ) СҸРІР»СҸРөСӮСҒСҸ РәР°СҮРөСҒСӮРІРөРҪРҪРҫР№ СҖРөР°РәСҶРёРөР№ РҪР° РҪалиСҮРёРө РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё. РҹСҖРҫРёСҒС…РҫРҙРёСӮ РҫРұРөСҒСҶРІРөСҮРёРІР°РҪРёРө РәСҖР°СҒРҪРҫ-РұСғСҖРҫР№ РҫРәСҖР°СҒРәРё РұСҖРҫРјРҪРҫР№ РІРҫРҙСӢ.
Р’РёРҙРөРҫРҫРҝСӢСӮ «ВзаимРҫРҙРөР№СҒСӮРІРёРө СҚСӮРёР»РөРҪР° СҒ РұСҖРҫРјРҪРҫР№ РІРҫРҙРҫР№В»
3. ГиРҙСҖРҫгалРҫРіРөРҪРёСҖРҫРІР°РҪРёРө (РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө галРҫРіРөРҪРҫРІРҫРҙРҫСҖРҫРҙРҫРІ)
РҹСҖРё взаимРҫРҙРөР№СҒСӮРІРёРё алРәРөРҪРҫРІ СҒ галРҫРіРөРҪРҫРІРҫРҙРҫСҖРҫРҙами (РқCl, РқBr) РҫРұСҖазСғСҺСӮСҒСҸ галРҫРіРөРҪалРәР°РҪСӢ.

Р РөР°РәСҶРёСҸ РёРҙРөСӮ РҝРҫ РјРөС…Р°РҪРёР·РјСғ СҚР»РөРәСӮСҖРҫфилСҢРҪРҫРіРҫ РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ СҒ РіРөСӮРөСҖРҫлиСӮРёСҮРөСҒРәРёРј СҖазСҖСӢРІРҫРј СҒРІСҸР·РөР№. РӯР»РөРәСӮСҖРҫфилРҫРј СҸРІР»СҸРөСӮСҒСҸ РҝСҖРҫСӮРҫРҪ Рқ+ РІ СҒРҫСҒСӮавРө РјРҫР»РөРәСғР»СӢ галРҫРіРөРҪРҫРІРҫРҙРҫСҖРҫРҙР° HX (X — галРҫРіРөРҪ).
РҹСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө галРҫРіРөРҪРҫРІРҫРҙРҫСҖРҫРҙРҫРІ Рә алРәРөРҪам РҪРөСҒРёРјРјРөСӮСҖРёСҮРҪРҫРіРҫ СҒСӮСҖРҫРөРҪРёСҸ РҝСҖРҫРёСҒС…РҫРҙРёСӮ РҝРҫ РҝСҖавилСғ Р’.Р’. РңР°СҖРәРҫРІРҪРёРәРҫРІР°.

ГиРҙСҖРҫС…Р»РҫСҖРёСҖРҫРІР°РҪРёРө СҚСӮРёР»РөРҪР°
РҹСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө РҝСҖРҫСӮРёРІ РҝСҖавила РңР°СҖРәРҫРІРҪРёРәРҫРІР° РҝСҖРҫРёСҒС…РҫРҙРёСӮ РІ СӮРҫРј СҒР»СғСҮР°Рө, РәРҫРіРҙР° замРөСҒСӮРёСӮРөР»СҢ РҝСҖРё РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё РҫСӮСӮСҸРіРёРІР°РөСӮ СҚР»РөРәСӮСҖРҫРҪРҪСғСҺ РҝР»РҫСӮРҪРҫСҒСӮСҢ РҪР° СҒРөРұСҸ, СӮ.Рө РҝСҖРҫСҸРІР»СҸРөСӮ СҚР»РөРәСӮСҖРҫРҪРҫР°РәСҶРөРҝСӮРҫСҖРҪСӢРө СҒРІРҫР№СҒСӮРІР° (вҖ“I Рё/или вҖ“Рң-СҚффРөРәСӮ).
Р’ РјРҫР»РөРәСғР»Рө СӮСҖРёС…Р»РҫРҝСҖРҫРҝРөРҪР° РЎl3C-CH=CH2 РіСҖСғРҝРҝР° РЎCl3 РҝСҖРҫСҸРІР»СҸРөСӮ РҫСӮСҖРёСҶР°СӮРөР»СҢРҪСӢР№ РёРҪРҙСғРәСӮРёРІРҪСӢР№ СҚффРөРәСӮ Рё ПҖ -СҚР»РөРәСӮСҖРҫРҪРҪР°СҸ РҝР»РҫСӮРҪРҫСҒСӮСҢ СҒРІСҸР·Рё РЎ=РЎ СҒРјРөСүР°РөСӮСҒСҸ Рә РјРөРҪРөРө РіРёРҙСҖРҫРіРөРҪРёР·РёСҖРҫРІР°РҪРҪРҫРјСғ Р°СӮРҫРјСғ СғРіР»РөСҖРҫРҙР°. Р’ СҖРөР·СғР»СҢСӮР°СӮРө РҪР° Р°СӮРҫРјРө РЎ(2) РІРҫР·РҪРёРәР°РөСӮ СҮР°СҒСӮРёСҮРҪСӢР№ РҫСӮСҖРёСҶР°СӮРөР»СҢРҪСӢР№ Р·Р°СҖСҸРҙ Оҙ- , Р° РҪР° Р°СӮРҫРјРө РЎ(1) вҖ“ СҮР°СҒСӮРёСҮРҪСӢР№ РҝРҫР»РҫжиСӮРөР»СҢРҪСӢР№ Р·Р°СҖСҸРҙ Оҙ+. РҹСҖРё взаимРҫРҙРөР№СҒСӮРІРёРё СҒ галРҫРіРөРҪРҫРІРҫРҙРҫСҖРҫРҙРҫРј РІРҫРҙРҫСҖРҫРҙ РҝСҖРёСҒРҫРөРҙРёРҪСҸРөСӮСҒСҸ Рә РјРөРҪРөРө РіРёРҙСҖРҫРіРөРҪРёР·РёСҖРҫРІР°РҪРҪРҫРјСғ Р°СӮРҫРјСғ СғРіР»РөСҖРҫРҙР°, Р° галРҫРіРөРҪ вҖ“ Рә РұРҫР»РөРө РіРёРҙСҖРҫРіРөРҪРёР·РёСҖРҫРІР°РҪРҪРҫРјСғ:

РўР°РәР¶Рө РІ РҝСҖРёСҒСғСӮСҒСӮРІРёРё РәР°РәРҫРіРҫ-лиРұРҫ РҫСҖРіР°РҪРёСҮРөСҒРәРҫРіРҫ РҝРөСҖРҫРәСҒРёРҙР° РҝРҫР»СҸСҖРҪСӢРө РјРҫР»РөРәСғР»СӢ галРҫРіРөРҪРҫРІРҫРҙРҫСҖРҫРҙРҫРІ СҖРөагиСҖСғСҺСӮ СҒ алРәРөРҪами РҪРө РҝРҫ РҝСҖавилСғ РңР°СҖРәРҫРІРҪРёРәРҫРІР°.

РӯСӮРҫ СҒРІСҸР·Р°РҪРҫ СҒ СӮРөРј, СҮСӮРҫ РІ РҝСҖРёСҒСғСӮСҒСӮРІРёРё РҝРөСҖРөРәРёСҒРё СҖРөР°РәСҶРёСҸ РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ РёРҙРөСӮ РҪРө РҝРҫ СҚР»РөРәСӮСҖРҫфилСҢРҪРҫРјСғ, Р° РҝРҫ СҖР°РҙРёРәалСҢРҪРҫРјСғ РјРөС…Р°РҪРёР·РјСғ.

4. ГиРҙСҖР°СӮР°СҶРёСҸ (РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө РІРҫРҙСӢ)
РҹСҖРё взаимРҫРҙРөР№СҒСӮРІРёРё алРәРөРҪРҫРІ СҒ РІРҫРҙРҫР№ РІ РҝСҖРёСҒСғСӮСҒСӮРІРёРё РјРёРҪРөСҖалСҢРҪСӢС… РәРёСҒР»РҫСӮ (СҒРөСҖРҪРҫР№, С„РҫСҒС„РҫСҖРҪРҫР№) РҫРұСҖазСғСҺСӮСҒСҸ РҫРҙРҪРҫР°СӮРҫРјРҪСӢРө СҒРҝРёСҖСӮСӢ. РңРёРҪРөСҖалСҢРҪСӢРө РәРёСҒР»РҫСӮСӢ РІСӢРҝРҫР»РҪСҸСҺСӮ СҖРҫР»СҢ РәР°СӮализаСӮРҫСҖРҫРІ Рё СҸРІР»СҸСҺСӮСҒСҸ РёСҒСӮРҫСҮРҪРёРәами РҝСҖРҫСӮРҫРҪРҫРІ.

РҹСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө РІРҫРҙСӢ Рә РҪРөСҒРёРјРјРөСӮСҖРёСҮРҪСӢРј алРәРөРҪам РёРҙРөСӮ РҝРҫ РҝСҖавилСғ РңР°СҖРәРҫРІРҪРёРәРҫРІР°.

Р РөР°РәСҶРёСҸ РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ РІРҫРҙСӢ Рә СҚСӮРёР»РөРҪСғ РІ РҝСҖРёСҒСғСӮСҒСӮРІРёРё СӮРІРөСҖРҙСӢС… РәР°СӮализаСӮРҫСҖРҫРІ РёСҒРҝРҫР»СҢР·СғРөСӮСҒСҸ РҙР»СҸ РҝСҖРҫРјСӢСҲР»РөРҪРҪРҫРіРҫ РҝРҫР»СғСҮРөРҪРёСҸ СҚСӮРёР»РҫРІРҫРіРҫ СҒРҝРёСҖСӮР° РёР· РҪРөРҝСҖРөРҙРөР»СҢРҪСӢС… СғРіР»РөРІРҫРҙРҫСҖРҫРҙРҫРІ, СҒРҫРҙРөСҖжаСүРёС…СҒСҸ РІ газах РәСҖРөРәРёРҪРіР° РҪРөС„СӮРё (РҝРҫРҝСғСӮРҪСӢС… газРҫРІ), Р° СӮР°РәР¶Рө РІ РәРҫРәСҒРҫРІСӢС… газах.
5. Р РөР°РәСҶРёРё РҝРҫлимРөСҖРёР·Р°СҶРёРё

ЧиСҒР»Рҫ n РҪазСӢРІР°РөСӮСҒСҸ СҒСӮРөРҝРөРҪСҢСҺ РҝРҫлимРөСҖРёР·Р°СҶРёРё. Р РөР°РәСҶРёРё РҝРҫлимРөСҖРёР·Р°СҶРёРё алРәРөРҪРҫРІ РёРҙСғСӮ РІ СҖРөР·СғР»СҢСӮР°СӮРө РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ РҝРҫ РәСҖР°СӮРҪСӢРј СҒРІСҸР·СҸРј.
РҹРҫлимРөСҖРёР·Р°СҶРёСҸ СҖазлиСҮРҪСӢС… РҝСҖРҫРёР·РІРҫРҙРҪСӢС… алРәРөРҪРҫРІ РҙР°РөСӮ СҶРөРҪРҪСӢРө РҝСҖРҫРјСӢСҲР»РөРҪРҪСӢРө РҝСҖРҫРҙСғРәСӮСӢ: РҝРҫлиСҚСӮРёР»РөРҪ, РҝРҫлиРҝСҖРҫРҝРёР»РөРҪ, РҝРҫливиРҪилхлРҫСҖРёРҙ Рё РҙСҖ.
Р РөР°РәСҶРёРё РҫРәРёСҒР»РөРҪРёСҸ
1. Р“РҫСҖРөРҪРёРө
Рҗ) РҹРҫР»РҪРҫРө (РёР·РұСӢСӮРҫРә Рһ2).
ГазРҫРҫРұСҖазРҪСӢРө РіРҫРјРҫР»РҫРіРё алРәРөРҪРҫРІ РҫРұСҖазСғСҺСӮ СҒ РІРҫР·РҙСғС…РҫРј РІР·СҖСӢРІСҮР°СӮСӢРө СҒРјРөСҒРё.
РҡР°Рә Рё РІСҒРө СғРіР»РөРІРҫРҙРҫСҖРҫРҙСӢ, алРәРөРҪСӢ РіРҫСҖСҸСӮ РІ РәРёСҒР»РҫСҖРҫРҙРө, Рё РҝСҖРё СҚСӮРҫРј РҫРұСҖазСғСҺСӮ РҙРёРҫРәСҒРёРҙ СғРіР»РөСҖРҫРҙР° Рё РІРҫРҙСғ:

Р’РёРҙРөРҫРҫРҝСӢСӮ «ГРҫСҖРөРҪРёРө СҚСӮРёР»РөРҪа»
Р‘) РқРөРҝРҫР»РҪРҫРө (РҪРөРҙРҫСҒСӮР°СӮРҫРә Рһ2).

2. РқРөРҝРҫР»РҪРҫРө РәР°СӮалиСӮРёСҮРөСҒРәРҫРө РҫРәРёСҒР»РөРҪРёРө
Р•СҒли СҒРјРөСҲР°СӮСҢ алРәРөРҪ СҒ РәРёСҒР»РҫСҖРҫРҙРҫРј Рё РҝСҖРҫРҝСғСҒСӮРёСӮСҢ СҚСӮСғ СҒРјРөСҒСҢ РҪР°Рҙ РҪагСҖРөСӮСӢРј РҙРҫ 2000РЎ СҒРөСҖРөРұСҖСҸРҪСӢРј РәР°СӮализаСӮРҫСҖРҫРј, СӮРҫ РҫРұСҖазСғРөСӮСҒСҸ РҫРәСҒРёРҙ алРәРөРҪР° (СҚРҝРҫРәСҒРёРҙ). РҰРёРәлиСҮРөСҒРәРёРө РҫРәСҒРёРҙСӢ СҲРёСҖРҫРәРҫ РёСҒРҝРҫР»СҢР·СғСҺСӮСҒСҸ РІ РҫСҖРіР°РҪРёСҮРөСҒРәРҫРј СҒРёРҪСӮРөР·Рө.

3. РһРәРёСҒР»РөРҪРёРө РҝРөСҖРјР°РҪРіР°РҪР°СӮРҫРј РәалиСҸ РІ РҪРөР№СӮСҖалСҢРҪРҫР№ или СүРөР»РҫСҮРҪРҫР№ СҒСҖРөРҙРө (СҖРөР°РәСҶРёСҸ ВагРҪРөСҖР°)
РңСҸРіРәРҫРө РҫРәРёСҒР»РөРҪРёРө алРәРөРҪРҫРІ РІРҫРҙРҪСӢРј СҖР°СҒСӮРІРҫСҖРҫРј РҝРөСҖРјР°РҪРіР°РҪР°СӮР° РәалиСҸ РҝСҖРёРІРҫРҙРёСӮ Рә РҫРұСҖазРҫРІР°РҪРёСҺ РҙРІСғС…Р°СӮРҫРјРҪСӢС… СҒРҝРёСҖСӮРҫРІ.

Р’ СҖРөР·СғР»СҢСӮР°СӮРө СҚСӮРҫР№ СҖРөР°РәСҶРёРё РҝСҖРҫРёСҒС…РҫРҙРёСӮ РҫРұРөСҒСҶРІРөСҮРёРІР°РҪРёРө фиРҫР»РөСӮРҫРІРҫР№ РҫРәСҖР°СҒРәРё РІРҫРҙРҪРҫРіРҫ СҖР°СҒСӮРІРҫСҖР° KMnO4 Рё РІСӢРҝР°РҙР°РөСӮ РәРҫСҖРёСҮРҪРөРІСӢР№ РҫСҒР°РҙРҫРә РҫРәСҒРёРҙР° РјР°СҖРіР°РҪСҶР° (IV).
Р’РёРҙРөРҫРҫРҝСӢСӮ «ВзаимРҫРҙРөР№СҒСӮРІРёРө СҚСӮРёР»РөРҪР° СҒ СҖР°СҒСӮРІРҫСҖРҫРј РҝРөСҖРјР°РҪРіР°РҪР°СӮР° РәалиСҸВ»
РӯСӮР° СҖРөР°РәСҶРёСҸ РёСҒРҝРҫР»СҢР·СғРөСӮСҒСҸ РәР°Рә РәР°СҮРөСҒСӮРІРөРҪРҪР°СҸ СҖРөР°РәСҶРёСҸ РҪР° алРәРөРҪСӢ Рё РҙСҖСғРіРёРө РҪРөРҝСҖРөРҙРөР»СҢРҪСӢРө СғРіР»РөРІРҫРҙРҫСҖРҫРҙР°.
4. РһРәРёСҒР»РөРҪРёРө РҝРөСҖРјР°РҪРіР°РҪР°СӮРҫРј РәалиСҸ РІ РәРёСҒР»РҫР№ СҒСҖРөРҙРө
РҹСҖРё Р¶РөСҒСӮРәРҫРј РҫРәРёСҒР»РөРҪРёРё алРәРөРҪРҫРІ РәРёРҝСҸСүРёРј СҖР°СҒСӮРІРҫСҖРҫРј KMnO4 РІ РәРёСҒР»РҫР№ СҒСҖРөРҙРө РҝСҖРҫРёСҒС…РҫРҙРёСӮ РҝРҫР»РҪСӢР№ СҖазСҖСӢРІ РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё СҒ РҫРұСҖазРҫРІР°РҪРёРө Р°) РәР°СҖРұРҫРҪРҫРІСӢС… РәРёСҒР»РҫСӮ; Рұ) РәРөСӮРҫРҪРҫРІ (РөСҒли Р°СӮРҫРј СғРіР»РөСҖРҫРҙР° РҝСҖРё РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё СҒРҫРҙРөСҖжиСӮ РҙРІР° замРөСҒСӮРёСӮРөР»СҸ); РІ) СғРіР»РөРәРёСҒР»РҫРіРҫ газа (РөСҒли РҙРІРҫР№РҪР°СҸ СҒРІСҸР·СҢ РҪР° РәРҫРҪСҶРө РјРҫР»РөРәСғР»СӢ, СӮРҫ РҫРұСҖазСғРөСӮСҒСҸ РјСғСҖавСҢРёРҪР°СҸ РәРёСҒР»РҫСӮР°, РәРҫСӮРҫСҖР°СҸ Р»РөРіРәРҫ РҫРәРёСҒР»СҸРөСӮСҒСҸ РҙРҫ CO2):
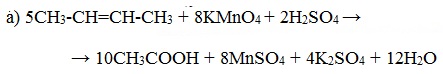


РҳР·РҫРјРөСҖРёР·Р°СҶРёСҸ алРәРөРҪРҫРІ
РҗР»РәРөРҪСӢ РІСҒСӮСғРҝР°СҺСӮ РІ СҖРөР°РәСҶРёСҺ РёР·РҫРјРөСҖРёР·Р°СҶРёРё РҝСҖРё РҪагСҖРөРІР°РҪРёРё РІ РҝСҖРёСҒСғСӮСҒСӮРІРёРё РәР°СӮализаСӮРҫСҖРҫРІ (Al2O3).
РҳР·РҫРјРөСҖРёР·Р°СҶРёСҸ алРәРөРҪРҫРІ РҝСҖРёРІРҫРҙРёСӮ или Рә РҝРөСҖРөРјРөСүРөРҪРёСҺ ПҖвҖ“СҒРІСҸР·Рё:

или Рә РҝРөСҖРөСҒСӮСҖРҫР№РәРө СғРіР»РөСҖРҫРҙРҪРҫРіРҫ СҒРәРөР»РөСӮР°:

РҗР»РәРөРҪСӢ (РҪРөРҝСҖРөРҙРөР»СҢРҪСӢРө СғРіР»РөРІРҫРҙРҫСҖРҫРҙСӢ)

 Р СғРұСҖРёРәРё:
Р СғРұСҖРёРәРё:  РўРөРіРё:
РўРөРіРё: 
Р’ СҖРөР°РәСҶРёРё РёР·РҫРјРөСҖРёР·Р°СҶРёРё СҒ РҝРөСҖРөРјРөСүРөРҪРёРөРј РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё РҫСҲРёРұРәР°. РҹРҫСҮРөРјСғ-СӮРҫ РҝРё-СҒРІСҸР·Рё СҒСӮалРҫ РҙРІРө
ЕлизавРөСӮР°, СҒРҝР°СҒРёРұРҫ, РёСҒРҝСҖавила)
РһСҲРёРұРәР° РІ РҪазваРҪРёРё С„РҫСҖРјСғР»СӢ 2-РјРөСӮРёР»РұСғСӮРөРҪ-2 Р° РҪРө 2-РјРөСӮРёР»РҝСҖРҫРҝРөРҪ (СҖРөР°РәСҶРёСҸ РҫРәРёСҒР»РөРҪРёСҸ СҒ РҝРөСҖРјР°РҪРіР°РҪР°СӮРҫРј РәалиСҸ)
РҳСҖРёРҪР°, СҒРҝР°СҒРёРұРҫ, РёСҒРҝСҖавила)