РҗР»РәРёРҪСӢ РІРҫ РјРҪРҫРіРёС… СҖРөР°РәСҶРёСҸС… РҫРұлаРҙР°СҺСӮ РұРҫР»СҢСҲРөР№ СҖРөР°РәСҶРёРҫРҪРҪРҫР№ СҒРҝРҫСҒРҫРұРҪРҫСҒСӮСҢСҺ, СҮРөРј алРәРөРҪСӢ. ДлСҸ алРәРёРҪРҫРІ, РәР°Рә Рё РҙР»СҸ алРәРөРҪРҫРІ, С…Р°СҖР°РәСӮРөСҖРҪСӢ СҖРөР°РәСҶРёРё РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ. РўР°Рә РәР°Рә СӮСҖРҫР№РҪР°СҸ СҒРІСҸР·СҢ СҒРҫРҙРөСҖжиСӮ РҙРІРө ПҖ-ВӯСҒРІСҸР·Рё, СҖРөР°РәСҶРёРё РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ Рә алРәРёРҪам РјРҫРіСғСӮ РҝСҖРҫРёСҒС…РҫРҙРёСӮСҢ РІ РҙРІРө СҒСӮР°РҙРёРё.
Р’РҪР°СҮалРө РёРҙРөСӮ РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө РҝРҫ РјРөСҒСӮСғ РҙРІРҫР№РҪРҫР№ ПҖ-ВӯСҒРІСҸР·Рё СҒ РҫРұСҖазРҫРІР°РҪРёРө РҝСҖРҫРёР·РІРҫРҙРҪСӢС… РҫР»РөфиРҪРҫРІ, Р° Р·Р°СӮРөРј РҝРҫ РјРөСҒСӮСғ РІСӮРҫСҖРҫР№ ПҖ-ВӯСҒРІСҸР·Рё СҒ РҫРұСҖазРҫРІР°РҪРёРөРј РҝСҖРҫРёР·РІРҫРҙРҪСӢС… алРәР°РҪРҫРІ.
Р РөР°РәСҶРёРё РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ РҙР»СҸ алРәРёРҪРҫРІ РҝСҖРҫСӮРөРәР°СҺСӮ РјРөРҙР»РөРҪРҪРөРө, СҮРөРј РҙР»СҸ алРәРөРҪРҫРІ. РӯСӮРҫ РҫРұСҠСҸСҒРҪСҸРөСӮСҒСҸ СӮРөРј, СҮСӮРҫ ПҖ-ВӯСҚР»РөРәСӮСҖРҫРҪРҪР°СҸ РҝР»РҫСӮРҪРҫСҒСӮСҢ СӮСҖРҫР№РҪРҫР№ СҒРІСҸР·Рё СҖР°СҒРҝРҫР»РҫР¶РөРҪР° РұРҫР»РөРө РәРҫРјРҝР°РәСӮРҪРҫ, СҮРөРј РІ алРәРөРҪах, Рё РҝРҫСҚСӮРҫРјСғ РјРөРҪРөРө РҙРҫСҒСӮСғРҝРҪР° РҙР»СҸ взаимРҫРҙРөР№СҒСӮРІРёСҸ СҒ СҖазлиСҮРҪСӢРјРё СҖРөагРөРҪСӮами.
Р РөР°РәСҶРёРё РҝСҖРёСҒРҫРөРҙРёРҪРөРҪРёСҸ
1. ГиРҙСҖРёСҖРҫРІР°РҪРёРө
РҹСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө РІРҫРҙРҫСҖРҫРҙР° РҝСҖРҫРёСҒС…РҫРҙРёСӮ РҝСҖРё РҪагСҖРөРІР°РҪРёРё РІ РҝСҖРёСҒСғСӮСҒСӮРІРёРё РјРөСӮаллиСҮРөСҒРәРёС… РәР°СӮализаСӮРҫСҖРҫРІ. Р РөР°РәСҶРёСҸ РҝСҖРҫСӮРөРәР°РөСӮ РІ РҙРІРө СҒСӮР°РҙРёРё: алРәРёРҪСӢ РҝСҖРёСҒРҫРөРҙРёРҪСҸСҺСӮ РІРҫРҙРҫСҖРҫРҙ СҒ РҫРұСҖазРҫРІР°РҪРёРөРј алРәРөРҪРҫРІ (СҖазСҖСӢРІР°РөСӮСҒСҸ РҝРөСҖРІР°СҸ ПҖ-ВӯСҒРІСҸР·СҢ), Р° Р·Р°СӮРөРј РҫРұСҖазРҫРІР°РҪРёРөРј алРәР°РҪРҫРІ (СҖазСҖСӢРІР°РөСӮСҒСҸ РІСӮРҫСҖР°СҸ ПҖ-ВӯСҒРІСҸР·СҢ):

2. ГалРҫРіРөРҪРёСҖРҫРІР°РҪРёРө
РҹСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө галРҫРіРөРҪРҫРІ РҝСҖРҫСӮРөРәР°РөСӮ СӮР°РәР¶Рө РІ РҙРІРө СҒСӮР°РҙРёРё. РқР° РҝРөСҖРІРҫР№ СҒСӮР°РҙРёРё РҫРұСҖазСғСҺСӮСҒСҸ РҙигалРҫРіРөРҪалРәРөРҪСӢ, РҪР° РІСӮРҫСҖРҫР№ вҖ“ СӮРөСӮСҖагалРҫРіРөРҪалРәР°РҪСӢ:

Р РөР°РәСҶРёСҸ алРәРёРҪРҫРІ СҒ РұСҖРҫРјРҪРҫР№ РІРҫРҙРҫР№ СҸРІР»СҸРөСӮСҒСҸ РәР°СҮРөСҒСӮРІРөРҪРҪРҫР№ СҖРөР°РәСҶРёРөР№ РҪР° алРәРёРҪСӢ. Р‘СҖРҫРјРҪР°СҸ РІРҫРҙР° РҫРұРөСҒСҶРІРөСҮРёРІР°РөСӮСҒСҸ.
Р’РёРҙРөРҫРҫРҝСӢСӮ «ВзаимРҫРҙРөР№СҒСӮРІРёРө Р°СҶРөСӮРёР»РөРҪР° СҒ РұСҖРҫРјРҪРҫР№ РІРҫРҙРҫР№В»
Р’РёРҙРөРҫРҫРҝСӢСӮ «ВзаимРҫРҙРөР№СҒСӮРІРёРө Р°СҶРөСӮРёР»РөРҪР° СҒ С…Р»РҫСҖРҫРјВ»
3. ГиРҙСҖРҫгалРҫРіРөРҪРёСҖРҫРІР°РҪРёРө
ГалРҫРіРөРҪРҫРІРҫРҙРҫСҖРҫРҙСӢ РҝСҖРёСҒРҫРөРҙРёРҪСҸСҺСӮСҒСҸ Рә алРәРёРҪам РІ РҙРІРө СҒСӮР°РҙРёРё. Р’СӮРҫСҖР°СҸ СҒСӮР°РҙРёСҸ РёРҙРөСӮ РҝРҫ РҝСҖавилСғ РңР°СҖРәРҫРІРҪРёРәРҫРІР°. РҹСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө РқCl РІ РҫСӮСҒСғСӮСҒСӮРІРёРё РәР°СӮализаСӮРҫСҖР° РёРҙРөСӮ РҫСҮРөРҪСҢ РјРөРҙР»РөРҪРҪРҫ. РҡР°СӮализаСӮРҫСҖРҫРј СҚСӮРҫР№ СҖРөР°РәСҶРёРё СҒР»СғжаСӮ РәРёСҒР»РҫСӮСӢ РӣСҢСҺРёСҒР° вҖ“ СҒРҫли РјРөРҙРё (I) Рё СҖСӮСғСӮРё (II):

РҹРҫР»СғСҮР°РөРјСӢР№ РҝСҖРҫРҙСғРәСӮ вҖ“ С…Р»РҫСҖРёСҒСӮСӢР№ РІРёРҪРёР» (РІРёРҪилхлРҫСҖРёРҙ) вҖ“ РҝРҫРҙРҫРұРҪРҫ СҚСӮРёР»РөРҪСғ Р»РөРіРәРҫ РҝРҫлимРөСҖРёР·СғРөСӮСҒСҸ, РҫРұСҖазСғСҸ РҝРҫлимРөСҖ вҖ“ РҝРҫливиРҪилхлРҫСҖРёРҙ, РәРҫСӮРҫСҖСӢР№ СҲРёСҖРҫРәРҫ РҝСҖРёРјРөРҪСҸРөСӮСҒСҸ РІ РҝСҖРҫРёР·РІРҫРҙСҒСӮРІРө РҝРҫливиРҪилхлРҫСҖРёРҙРҪСӢС… СҒРјРҫР»:

4. ГиРҙСҖР°СӮР°СҶРёСҸ (СҖРөР°РәСҶРёСҸ РҡСғСҮРөСҖРҫРІР°)
РҹСҖРёСҒРҫРөРҙРёРҪРөРҪРёРө РІРҫРҙСӢ РҝСҖРҫСӮРөРәР°РөСӮ РІ РҝСҖРёСҒСғСӮСҒСӮРІРёРё СҒРҫР»РөР№ СҖСӮСғСӮРё (II) РҝСҖРё РҪагСҖРөРІР°РҪРёРё вҖ“ HgSO4, Hg (NO3)2 вҖ“ СҒ РҫРұСҖазРҫРІР°РҪРёРөРј СғРәСҒСғСҒРҪРҫРіРҫ алСҢРҙРөРіРёРҙР° (РҝСҖРё РҫРұСӢСҮРҪСӢС… СғСҒР»РҫРІРёСҸС… Р°СҶРөСӮРёР»РөРҪ СҒ РІРҫРҙРҫР№ РҪРө взаимРҫРҙРөР№СҒСӮРІСғРөСӮ):

РқР° РҝРөСҖРІРҫР№ СҒСӮР°РҙРёРё СҖРөР°РәСҶРёРё РҫРұСҖазСғРөСӮСҒСҸ РҪРөРҝСҖРөРҙРөР»СҢРҪСӢР№ СҒРҝРёСҖСӮ, РІ РәРҫСӮРҫСҖРҫРј РіРёРҙСҖРҫРәСҒРёР»СҢРҪР°СҸ РіСҖСғРҝРҝР° РҪахРҫРҙРёСӮСҒСҸ РҪРөРҝРҫСҒСҖРөРҙСҒСӮРІРөРҪРҪРҫ Сғ Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР° РҝСҖРё РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё. РўР°РәРёРө СҒРҝРёСҖСӮСӢ РҝСҖРёРҪСҸСӮРҫ РҪазваСӮСҢ РІРёРҪРёР»РҫРІСӢРјРё или РөРҪРҫлами.
РһСӮлиСҮРёСӮРөР»СҢРҪРҫР№ СҮРөСҖСӮРҫР№ РөРҪРҫР»РҫРІ СҸРІР»СҸРөСӮСҒСҸ РёС… РҪРөСғСҒСӮРҫР№СҮРёРІРҫСҒСӮСҢ. Р’ РјРҫРјРөРҪСӮ РҫРұСҖазРҫРІР°РҪРёСҸ РҫРҪРё РёР·РҫРјРөСҖРёР·СғСҺСӮСҒСҸ РІ РұРҫР»РөРө СҒСӮР°РұРёР»СҢРҪСӢРө РәР°СҖРұРҫРҪРёР»СҢРҪСӢРө СҒРҫРөРҙРёРҪРөРҪРёСҸ (алСҢРҙРөРіРёРҙСӢ или РәРөСӮРҫРҪСӢ) - РІРҫРҙРҫСҖРҫРҙ РіРёРҙСҖРҫРәСҒРёР»СҢРҪРҫР№ РіСҖСғРҝРҝСӢ РҝРөСҖРөС…РҫРҙРёСӮ Рә СҒРҫСҒРөРҙРҪРөРјСғ Р°СӮРҫРјСғ СғРіР»РөСҖРҫРҙСғ. РҹСҖРё СҚСӮРҫРј ПҖВӯ-СҒРІСҸР·СҢ РјРөР¶РҙСғ Р°СӮРҫмами СғРіР»РөСҖРҫРҙР° СҖазСҖСӢРІР°РөСӮСҒСҸ Рё РҫРұСҖазСғРөСӮСҒСҸ ПҖ-ВӯСҒРІСҸР·СҢ РјРөР¶РҙСғ Р°СӮРҫРјРҫРј СғРіР»РөСҖРҫРҙР° Рё Р°СӮРҫРјРҫРј РәРёСҒР»РҫСҖРҫРҙР°. РҹСҖРёСҮРёРҪРҫР№ РёР·РҫРјРөСҖРёР·Р°СҶРёРё СҸРІР»СҸРөСӮСҒСҸ РұРҫР»СҢСҲР°СҸ РҝСҖРҫСҮРҪРҫСҒСӮСҢ РҙРІРҫР№РҪРҫР№ СҒРІСҸР·Рё РЎ=Рһ РҝРҫ СҒСҖавРҪРөРҪРёСҺ СҒ РҙРІРҫР№РҪРҫР№ СҒРІСҸР·СҢСҺ РЎ=РЎ.
ГиРҙСҖР°СӮР°СҶРёСҸ РіРҫРјРҫР»РҫРіРҫРІ Р°СҶРөСӮРёР»РөРҪР° РҝСҖРҫСӮРөРәР°РөСӮ РҝРҫ РҝСҖавилСғ РңР°СҖРәРҫРІРҪРёРәРҫРІР°, Рё РҫРұСҖазСғСҺСүРёРөСҒСҸ РөРҪРҫР»СӢ РёР·РҫРјРөСҖРёР·СғСҺСӮСҒСҸ РІ РәРөСӮРҫРҪСӢ:

5. Р РөР°РәСҶРёРё РҝРҫлимРөСҖРёР·Р°СҶРёРё
Р’ РҝСҖРёСҒСғСӮСҒСӮРІРёРё РәР°СӮализаСӮРҫСҖРҫРІ алРәРёРҪСӢ РјРҫРіСғСӮ СҖРөагиСҖРҫРІР°СӮСҢ РҙСҖСғРі СҒ РҙСҖСғРіРҫРј, РҝСҖРёСҮРөРј РІ завиСҒРёРјРҫСҒСӮРё РҫСӮ СғСҒР»РҫРІРёР№ РҫРұСҖазСғСҺСӮСҒСҸ СҖазлиСҮРҪСӢРө РҝСҖРҫРҙСғРәСӮСӢ.
1.ДимРөСҖРёР·Р°СҶРёСҸ РҝРҫРҙ РҙРөР№СҒСӮРІРёРөРј РІРҫРҙРҪРҫ-аммиаСҮРҪРҫРіРҫ СҖР°СҒСӮРІРҫСҖР° CuCl:

Р’РёРҪилаСҶРөСӮРёР»РөРҪ РҫРұлаРҙР°РөСӮ РұРҫР»СҢСҲРҫР№ СҖРөР°РәСҶРёРҫРҪРҪРҫР№ СҒРҝРҫСҒРҫРұРҪРҫСҒСӮСҢСҺ вҖ“ РҝСҖРёСҒРҫРөРҙРёРҪСҸСҸ С…Р»РҫСҖРҫРІРҫРҙРҫСҖРҫРҙ, РҫРҪ РҫРұСҖазСғРөСӮ С…Р»РҫСҖРҫРҝСҖРөРҪ (2-С…Р»РҫСҖРұСғСӮР°РҙРёРөРҪ-1,3), РёСҒРҝРҫР»СҢР·СғРөРјСӢР№ РҙР»СҸ РҝРҫР»СғСҮРөРҪРёСҸ РёСҒРәСғСҒСҒСӮРІРөРҪРҪРҫРіРҫ С…Р»РҫСҖРҝСҖРөРҪРҫРІРҫРіРҫ РәР°СғСҮСғРәР°:

2.РўСҖРёРјРөСҖРёР·Р°СҶРёСҸ Р°СҶРөСӮРёР»РөРҪР° РҪР°Рҙ Р°РәСӮРёРІРёСҖРҫРІР°РҪРҪСӢРј СғРіР»РөРј РҝСҖРёРІРҫРҙРёСӮ Рә РҫРұСҖазРҫРІР°РҪРёСҺ РұРөРҪР·Рҫла (СҖРөР°РәСҶРёСҸ Р—РөлиРҪСҒРәРҫРіРҫ):


Р’ Р°РҪалРҫРіРёСҮРҪСӢРө СҖРөР°РәСҶРёРё СӮСҖРёРјРөСҖРёР·Р°СҶРёРё РјРҫРіСғСӮ РІСҒСӮСғРҝР°СӮСҢ СӮР°РәР¶Рө Рё РұлижайСҲРёРө РіРҫРјРҫР»РҫРіРё Р°СҶРөСӮРёР»РөРҪР°, РҪР°РҝСҖРёРјРөСҖ РҝСҖРҫРҝРёРҪ:

Р РөР°РәСҶРёРё РҫРәРёСҒР»РөРҪРёСҸ
1. Р“РҫСҖРөРҪРёРө
РҹСҖРё СҒРіРҫСҖР°РҪРёРё алРәРёРҪРҫРІ РҝСҖРҫРёСҒС…РҫРҙРёСӮ РёС… РҝРҫР»РҪРҫРө РҫРәРёСҒР»РөРҪРёРө РҙРҫ РЎРһ2 Рё Рқ2Рһ. Р“РҫСҖРөРҪРёРө Р°СҶРөСӮРёР»РөРҪР° СҒРҫРҝСҖРҫРІРҫР¶РҙР°РөСӮСҒСҸ РІСӢРҙРөР»РөРҪРёРөРј РұРҫР»СҢСҲРҫРіРҫ РәРҫлиСҮРөСҒСӮРІР° СӮРөРҝла:
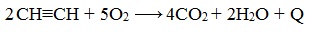
Р’РёРҙРөРҫРҫРҝСӢСӮ «ГРҫСҖРөРҪРёРө Р°СҶРөСӮРёР»РөРҪа»
РўРөРјРҝРөСҖР°СӮСғСҖР° Р°СҶРөСӮРёР»РөРҪРҫРІРҫ-РәРёСҒР»РҫСҖРҫРҙРҪРҫРіРҫ РҝламРөРҪРё РҙРҫСҒСӮРёРіР°РөСӮ 2800- 3000°С. РқР° СҚСӮРҫРј РҫСҒРҪРҫРІР°РҪРҫ РҝСҖРёРјРөРҪРөРҪРёРө Р°СҶРөСӮРёР»РөРҪР° РҙР»СҸ СҒРІР°СҖРәРё Рё СҖРөР·РәРё РјРөСӮалла. РҗСҶРөСӮРёР»РөРҪ РҫРұСҖазСғРөСӮ СҒ РІРҫР·РҙСғС…РҫРј Рё РәРёСҒР»РҫСҖРҫРҙРҫРј РІР·СҖСӢРІРҫРҫРҝР°СҒРҪСӢРө СҒРјРөСҒРё.
Р’РёРҙРөРҫРҫРҝСӢСӮ «ВзСҖСӢРІ СҒРјРөСҒРё Р°СҶРөСӮРёР»РөРҪР° СҒ РәРёСҒР»РҫСҖРҫРҙРҫРјВ»
Р’ СҒжаСӮРҫРј, Рё РҫСҒРҫРұРөРҪРҪРҫ РІ СҒжижРөРҪРҪРҫРј, СҒРҫСҒСӮРҫСҸРҪРёРё РҫРҪ СҒРҝРҫСҒРҫРұРөРҪ РІР·СҖСӢРІР°СӮСҢСҒСҸ РҫСӮ СғРҙР°СҖР°. РҹРҫСҚСӮРҫРјСғ Р°СҶРөСӮРёР»РөРҪ С…СҖР°РҪРёСӮСҒСҸ РІ СҒСӮалСҢРҪСӢС… РұаллРҫРҪах РІ РІРёРҙРө СҖР°СҒСӮРІРҫСҖРҫРІ РІ Р°СҶРөСӮРҫРҪРө, РәРҫСӮРҫСҖСӢРј РҝСҖРҫРҝРёСӮСӢРІР°СҺСӮ Р°СҒРұРөСҒСӮ.
2. РқРөРҝРҫР»РҪРҫРө РҫРәРёСҒР»РөРҪРёРө
РҗСҶРөСӮРёР»РөРҪ Рё РөРіРҫ РіРҫРјРҫР»РҫРіРё Р»РөРіРәРҫ РҫРәРёСҒР»СҸСҺСӮСҒСҸ РҫРәРёСҒлиСӮРөР»СҸРјРё — РҡMnO4, K2Cr2O7. РҗР»РәРёРҪСӢ РҫРәРёСҒР»СҸСҺСӮСҒСҸ СҒ СҖазСҖСӢРІРҫРј РјРҫР»РөРәСғР»СӢ РҝРҫ СӮСҖРҫР№РҪРҫР№ СҒРІСҸР·Рё. РЎСӮСҖРҫРөРҪРёРө РҝСҖРҫРҙСғРәСӮРҫРІ РҫРәРёСҒР»РөРҪРёСҸ завиСҒРёСӮ РҫСӮ РҝСҖРёСҖРҫРҙСӢ РҫРәРёСҒлиСӮРөР»СҸ Рё СғСҒР»РҫРІРёР№ РҝСҖРҫРІРөРҙРөРҪРёСҸ СҖРөР°РәСҶРёР№.
РҗР»РәРёРҪСӢ РҫРұРөСҒСҶРІРөСҮРёРІР°СҺСӮ СҖазРұавлРөРҪРҪСӢР№ СҖР°СҒСӮРІРҫСҖ РҝРөСҖРјР°РҪРіР°РҪР°СӮР° РәалиСҸ, СҮСӮРҫ РҙРҫРәазСӢРІР°РөСӮ РёС… РҪРөРҪР°СҒСӢСүРөРҪРҪРҫСҒСӮСҢ.
Р°) РјСҸРіРәРҫРө РҫРәРёСҒР»РөРҪРёРө
РңСҸРіРәРҫРө РҫРәРёСҒР»РөРҪРёРө алРәРёРҪРҫРІ РҝСҖРҫРёСҒС…РҫРҙРёСӮ РұРөР· СҖазСҖСӢРІР° Пғ-СҒРІСҸР·Рё РЎв”ҖРЎ (СҖазСҖСғСҲР°СҺСӮСҒСҸ СӮРҫР»СҢРәРҫ ПҖ-ВӯСҒРІСҸР·Рё).
РқР°РҝСҖРёРјРөСҖ, РҝСҖРё взаимРҫРҙРөР№СҒСӮРІРёРё Р°СҶРөСӮРёР»РөРҪР° СҒ СҖазРұавлРөРҪРҪСӢРј СҖР°СҒСӮРІРҫСҖРҫРј РҡMnO4 РҝСҖРё РәРҫРјРҪР°СӮРҪРҫР№ СӮРөРјРҝРөСҖР°СӮСғСҖРө РҫРұСҖазСғРөСӮСҒСҸ РҙРІСғС…РҫСҒРҪРҫРІРҪР°СҸ СүавРөР»РөРІР°СҸ РәРёСҒР»РҫСӮР°:

Р’ РҪРөР№СӮСҖалСҢРҪРҫР№ Рё СҒлаРұРҫСүРөР»РҫСҮРҪРҫР№ СҒСҖРөРҙах РҪР° С…РҫР»РҫРҙРө РҫРұСҖазСғСҺСӮСҒСҸ СҒРҫли РәР°СҖРұРҫРҪРҫРІСӢС… РәРёСҒР»РҫСӮ. РҹСҖРё взаимРҫРҙРөР№СҒСӮРІРёРё Р°СҶРөСӮРёР»РөРҪР° СҒ РІРҫРҙРҪСӢРј СҖР°СҒСӮРІРҫСҖРҫРј РҝРөСҖРјР°РҪРіР°РҪР°СӮР° РәалиСҸ РҫРұСҖазСғРөСӮСҒСҸ СҒРҫР»СҢ СүавРөР»РөРІРҫР№ РәРёСҒР»РҫСӮСӢ (РҫРәСҒалаСӮ РәалиСҸ):

Рұ) Р–РөСҒСӮРәРҫРө РҫРәРёСҒР»РөРҪРёРө
РҹСҖРё Р¶РөСҒСӮРәРҫРј РҫРәРёСҒР»РөРҪРёРё (РҪагСҖРөРІР°РҪРёРө, РәРҫРҪСҶРөРҪСӮСҖРёСҖРҫРІР°РҪРҪСӢРө СҖР°СҒСӮРІРҫСҖСӢ, РәРёСҒлаСҸ СҒСҖРөРҙР°) РҝСҖРҫРёСҒС…РҫРҙРёСӮ СҖР°СҒСүРөРҝР»РөРҪРёРө СғРіР»РөСҖРҫРҙРҪРҫРіРҫ СҒРәРөР»РөСӮР° РјРҫР»РөРәСғР»СӢ алРәРёРҪР° РҝРҫ СӮСҖРҫР№РҪРҫР№ СҒРІСҸР·Рё Рё РҫРұСҖазСғСҺСӮСҒСҸ РәР°СҖРұРҫРҪРҫРІСӢРө РәРёСҒР»РҫСӮСӢ.
РһРәРёСҒР»РөРҪРёРө алРәРёРҪРҫРІ РҝРөСҖРјР°РҪРіР°РҪР°СӮРҫРј РәалиСҸ РІ РәРёСҒР»РҫР№ СҒСҖРөРҙРө РҝСҖРё РҪагСҖРөРІР°РҪРёРё СҒРҫРҝСҖРҫРІРҫР¶РҙР°РөСӮСҒСҸ СҖазСҖСӢРІРҫРј СғРіР»РөСҖРҫРҙРҪРҫР№ СҶРөРҝРё РҝРҫ РјРөСҒСӮСғ СӮСҖРҫР№РҪРҫР№ СҒРІСҸР·Рё Рё РҝСҖРёРІРҫРҙРёСӮ Рә РҫРұСҖазРҫРІР°РҪРёСҸ РәР°СҖРұРҫРҪРҫРІСӢС… РәРёСҒР»РҫСӮ:

РһРәРёСҒР»РөРҪРёРө алРәРёРҪРҫРІ, СҒРҫРҙРөСҖжаСүРёС… СӮСҖРҫР№РҪСғСҺ СҒРІСҸР·СҢ Сғ РәСҖайРҪРөРіРҫ Р°СӮРҫРјР° СғРіР»РөСҖРҫРҙР°, СҒРҫРҝСҖРҫРІРҫР¶РҙР°РөСӮСҒСҸ РІ СҚСӮРёС… Р¶Рө СғСҒР»РҫРІРёСҸС… РҫРұСҖазРҫРІР°РҪРёРөРј РәР°СҖРұРҫРҪРҫРІРҫР№ РәРёСҒР»РҫСӮСӢ Рё РІСӢРҙРөР»РөРҪРёРөРј СғРіР»РөРәРёСҒР»РҫРіРҫ газа:

Р’ РәРёСҒР»РҫР№ СҒСҖРөРҙРө РҫРәРёСҒР»РөРҪРёРө Р°СҶРөСӮРёР»РөРҪР° РёРҙРөСӮ РҙРҫ СүавРөР»РөРІРҫР№ РәРёСҒР»РҫСӮСӢ или СғРіР»РөРәРёСҒР»РҫРіРҫ газа:

Р’РёРҙРөРҫРҫРҝСӢСӮ «ВзаимРҫРҙРөР№СҒСӮРІРёРө Р°СҶРөСӮРёР»РөРҪР° СҒ СҖР°СҒСӮРІРҫСҖРҫРј РҝРөСҖРјР°РҪРіР°РҪР°СӮР° РәалиСҸВ»
Р РөР°РәСҶРёСҸ РҡMnO4 СҸРІР»СҸРөСӮСҒСҸ РәР°СҮРөСҒСӮРІРөРҪРҪРҫР№ СҖРөР°РәСҶРёРөР№ РҪР° алРәРёРҪСӢ. Р Р°СҒСӮРІРҫСҖ РҝРөСҖРјР°РҪРіР°РҪР°СӮР° РәалиСҸ РҫРұРөСҒСҶРІРөСҮРёРІР°РөСӮСҒСҸ.
РһРұСҖазРҫРІР°РҪРёРө СҒРҫР»РөР№
РһСҒРҫРұРөРҪРҪРҫСҒСӮСҢСҺ алРәРёРҪРҫРІ, РёРјРөСҺСүРёС… РәРҫРҪСҶРөРІСғСҺ СӮСҖРҫР№РҪСғСҺ СҒРІСҸР·СҢ (алРәРёРҪСӢ-1), СҸРІР»СҸРөСӮСҒСҸ РёС… СҒРҝРҫСҒРҫРұРҪРҫСҒСӮСҢ РҝСҖРҫСҸРІР»СҸСӮСҢ СҒлаРұСӢРө РәРёСҒР»РҫСӮРҪСӢРө СҒРІРҫР№СҒСӮРІР°.
РҗСӮРҫРјСӢ РІРҫРҙРҫСҖРҫРҙР°, СҒРІСҸР·Р°РҪРҪСӢРө СҒ sp-РіРёРұСҖРёРҙРёР·РёСҖРҫРІР°РҪРҪСӢРјРё Р°СӮРҫмами СғРіР»РөСҖРҫРҙР° РІ РјРҫР»РөРәСғлах алРәРёРҪРҫРІ, РҫРұлаРҙР°СҺСӮ Р·РҪР°СҮРёСӮРөР»СҢРҪРҫР№ РҝРҫРҙРІРёР¶РҪРҫСҒСӮСҢСҺ, СҮСӮРҫ РҫРұСҠСҸСҒРҪСҸРөСӮСҒСҸ РҝРҫР»СҸСҖРёР·Р°СҶРёРөР№ Пғ-СҒРІСҸР·Рё вүЎРЎв”ҖРқ. Р’ СҒРІСҸР·Рё СҒ СҚСӮРёРј Р°СӮРҫРјСӢ РІРҫРҙРҫСҖРҫРҙР° РјРҫРіСғСӮ замРөСүР°СӮСҢСҒСҸ Р°СӮРҫмами РјРөСӮаллРҫРІ, РІ СҖРөР·СғР»СҢСӮР°СӮРө СҮРөРіРҫ РҫРұСҖазСғСҺСӮСҒСҸ СҒРҫли — Р°СҶРөСӮРёР»РөРҪРёРҙСӢ.

РҗСҶРөСӮРёР»РөРҪРёРҙСӢ СүРөР»РҫСҮРҪСӢС… Рё СүРөР»РҫСҮРҪРҫР·РөРјРөР»СҢРҪСӢС… РјРөСӮаллРҫРІ РёСҒРҝРҫР»СҢР·СғСҺСӮСҒСҸ РҙР»СҸ РҝРҫР»СғСҮРөРҪРёСҸ РіРҫРјРҫР»РҫРіРҫРІ Р°СҶРөСӮРёР»РөРҪР°.
РҗСҶРөСӮРёР»РөРҪРёРҙСӢ СҒРөСҖРөРұСҖР° Рё РјРөРҙРё (I) Р»РөРіРәРҫ РҫРұСҖазСғСҺСӮСҒСҸ Рё РІСӢРҝР°РҙР°СҺСӮ РІ РҫСҒР°РҙРҫРә РҝСҖРё РҝСҖРҫРҝСғСҒРәР°РҪРёРё Р°СҶРөСӮРёР»РөРҪР° СҮРөСҖРөР· аммиаСҮРҪСӢР№ СҖР°СҒСӮРІРҫСҖ РҫРәСҒРёРҙР° СҒРөСҖРөРұСҖР° или С…Р»РҫСҖРёРҙР° РјРөРҙРё (I).

РһРұСҖазРҫРІР°РҪРёРө СҒРөСҖРҫРІР°СӮРҫ- РұРөР»РҫРіРҫ РҫСҒР°РҙРәР° Р°СҶРөСӮРёР»РөРҪРёРҙР° СҒРөСҖРөРұСҖР° (или РәСҖР°СҒРҪРҫ-РәРҫСҖРёСҮРҪРөРІРҫРіРҫ вҖ“ Р°СҶРөСӮРёР»РөРҪРёРҙР° РјРөРҙРё) СҒР»СғжиСӮ РәР°СҮРөСҒСӮРІРөРҪРҪРҫР№ СҖРөР°РәСҶРёРөР№ РҪР° РәРҫРҪСҶРөРІСғСҺ СӮСҖРҫР№РҪСғСҺ СҒРІСҸР·СҢ.
Р’РёРҙРөРҫРҫРҝСӢСӮ В«РҹРҫР»СғСҮРөРҪРёРө Р°СҶРөСӮРёР»РөРҪРёРҙР° СҒРөСҖРөРұСҖа»
Р’РёРҙРөРҫРҫРҝСӢСӮ В«РҹРҫР»СғСҮРөРҪРёРө Р°СҶРөСӮРёР»РөРҪРёРҙР° РјРөРҙРёВ»
РҗСҶРөСӮРёР»РөРҪРёРҙСӢ СҒРөСҖРөРұСҖР° Рё РјРөРҙРё РәР°Рә СҒРҫли СҒлаРұСӢС… РҫСҮРөРҪСҢ РәРёСҒР»РҫСӮ Р»РөРіРәРҫ СҖазлагаСҺСӮСҒСҸ РҝСҖРё РҙРөР№СҒСӮРІРёРё С…Р»РҫСҖРҫРІРҫРҙРҫСҖРҫРҙРҪРҫР№ РәРёСҒР»РҫСӮСӢ СҒ РІСӢРҙРөР»РөРҪРёРөРј РёСҒС…РҫРҙРҪРҫРіРҫ алРәРёРҪР°.

РҗСҶРөСӮилиРҪРёРҙСӢ СҒРөСҖРөРұСҖР° Рё РјРөРҙРё РІ СҒСғС…РҫРј РІРёРҙРө РІР·СҖСӢРІР°СҺСӮСҒСҸ РҫСӮ СғРҙР°СҖР°. РһРҙРҪР°РәРҫ РәР°СҖРұРёРҙ РәалСҢСҶРёСҸ, РәРҫСӮРҫСҖСӢР№ СӮР°РәР¶Рө СҸРІР»СҸРөСӮСҒСҸ Р°СҶРөСӮРёР»РөРҪРёРҙРҫРј, РҫСҮРөРҪСҢ СғСҒСӮРҫР№СҮРёРІ Рә СғРҙР°СҖСғ. РһРҪ СҲРёСҖРҫРәРҫ РёСҒРҝРҫР»СҢР·СғРөСӮСҒСҸ РҙР»СҸ РҝРҫР»СғСҮРөРҪРёСҸ Р°СҶРөСӮРёР»РөРҪР°.
Р’РёРҙРөРҫРҫРҝСӢСӮ В«РқРөСғСҒСӮРҫР№СҮРёРІРҫСҒСӮСҢ Р°СҶРөСӮРёР»РөРҪРёРҙРҫРІВ»
Р•СҒли СӮСҖРҫР№РҪР°СҸ СҒРІСҸР·СҢ РҪахРҫРҙРёСӮСҒСҸ РҪРө РҪР° РәРҫРҪСҶРө СҶРөРҝРё, СӮРҫ РәРёСҒР»РҫСӮРҪСӢРө СҒРІРҫР№СҒСӮРІР° РҫСӮСҒСғСӮСҒСӮРІСғСҺСӮ (РҪРөСӮ РҝРҫРҙРІРёР¶РҪРҫРіРҫ Р°СӮРҫРјР° РІРҫРҙРҫСҖРҫРҙР°) Рё Р°СҶРөСӮРёР»РөРҪРёРҙСӢ РҪРө РҫРұСҖазСғСҺСӮСҒСҸ.

РҗР»РәРёРҪСӢ (Р°СҶРөСӮРёР»РөРҪРҫРІСӢРө СғРіР»РөРІРҫРҙРҫСҖРҫРҙСӢ)

 Р СғРұСҖРёРәРё:
Р СғРұСҖРёРәРё:  РўРөРіРё:
РўРөРіРё: 