Современная теория строения молекулы бензола базируется на представлении о гибридизации орбиталей атома углерода.
Учебный фильм «Строение молекулы бензола»
Согласно этой теории, атомы углерода в бензоле находятся в состоянии sp2-гибридизации.
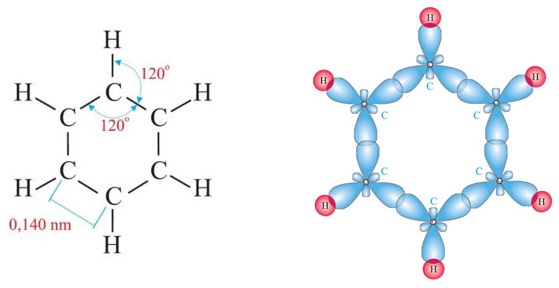
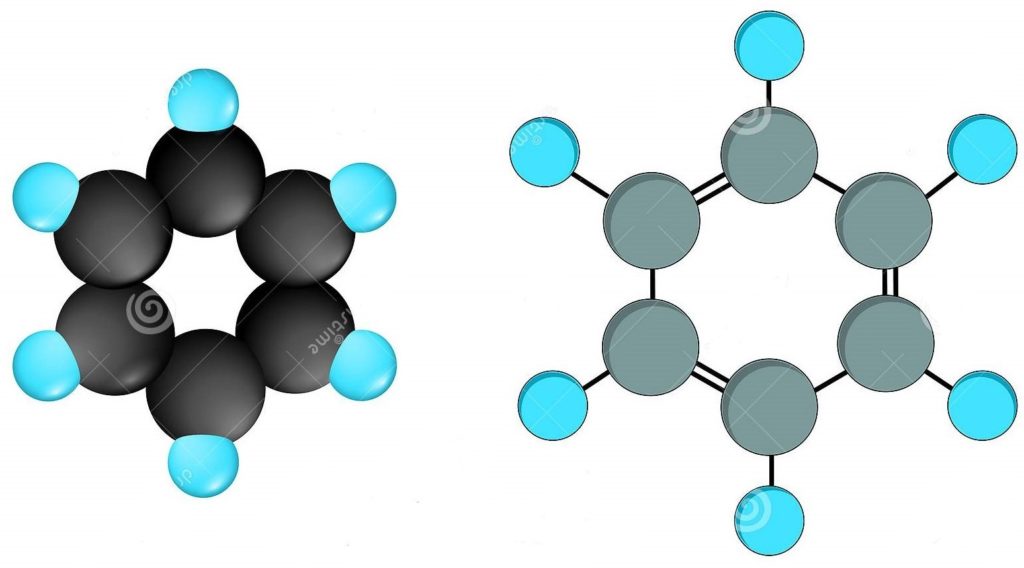
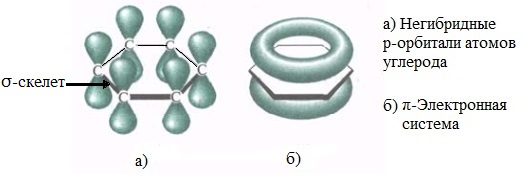
Каждый атом углерода образует три σ-связи (две с атомами углерода и одну – с атомом водорода). Валентные углы между каждой парой σ-связей равны 120°. Таким образом, все шесть атомов углерода и все σ-связи С-С и С-лежат в одной плоскости, образуя правильный шестиугольник (σ-скелет молекулы бензола).
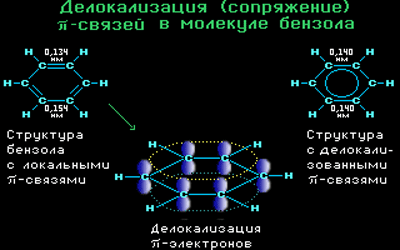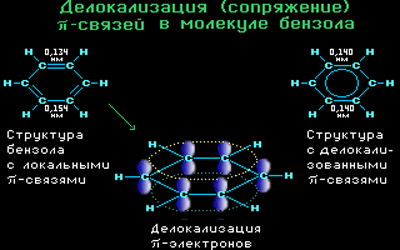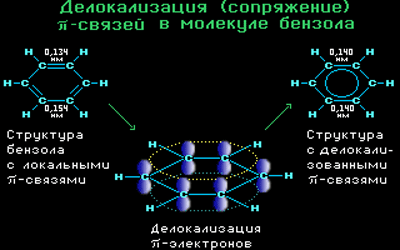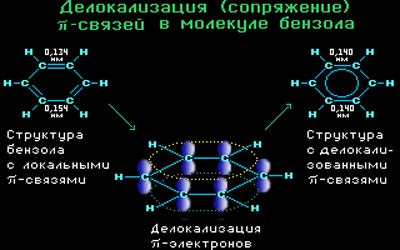
Каждый атом углерода имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. Все шесть р-электронов взаимодействуют между собой, образуя π-связи, не локализованные в пары, как при образовании обычных двойных связей, а образующие единое π-электронное облако и единую химическую связь для всех атомов углерода.
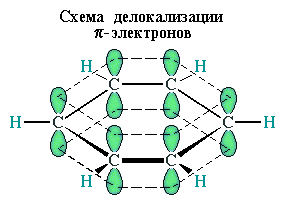
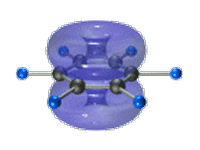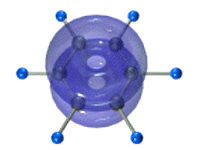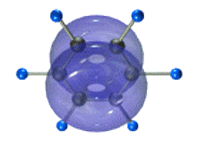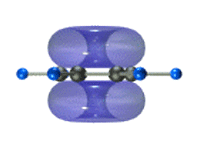
Таким образом, в молекуле бензола осуществляется круговое сопряжение, образуется единая сопряженная π-система. Наибольшая π-электронная плотность в этой сопряженной системе располагается над и под плоскостью σ-скелета.
Сочетание шести σ-связей с единой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.

π-Электронное облако обусловливает сокращение расстояния между атомами углерода.
Все связи С-С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – «полуторная» – промежуточная между простой и двойной, так называемая ароматическая связь.
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) с окружностью внутри, обозначающего делокализованные π-связи.
Такое электронное строение объясняет все особенности бензола. Становится понятно, почему бензол трудно вступает в реакции присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Таким образом, наряду с формулой Кекуле используется формула бензола, где обобщенное электронное облако изображают замкнутой линией внутри кольца.

Ароматические углеводороды (арены)

 Рубрики:
Рубрики:  Теги:
Теги: 