–•–Є–Љ–Є—З–µ—Б–Ї–Њ–µ —Б—В—А–Њ–µ–љ–Є–µ (–њ–Њ—А—П–і–Њ–Ї —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –∞—В–Њ–Љ–Њ–≤ –≤ –Љ–Њ–ї–µ–Ї—Г–ї–∞—Е) –њ—А–Њ—Б—В–µ–є—И–Є—Е –∞–ї–Ї–∞–љ–Њ–≤ вАУ –Љ–µ—В–∞–љ–∞, —Н—В–∞–љ–∞ –Є –њ—А–Њ–њ–∞–љ–∞ вАУ –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В –Є—Е —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ —Д–Њ—А–Љ—Г–ї—Л. –Ш–Ј —Н—В–Є—Е —Д–Њ—А–Љ—Г–ї –≤–Є–і–љ–Њ, —З—В–Њ –≤ –∞–ї–Ї–∞–љ–∞—Е –Є–Љ–µ—О—В—Б—П –і–≤–∞ —В–Є–њ–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Б–≤—П–Ј–µ–є:
–°вАУ–° –Є –°вАУ–Э
–°–≤—П–Ј—М –°вАУ–° —П–≤–ї—П–µ—В—Б—П –Ї–Њ–≤–∞–ї–µ–љ—В–љ–Њ–є –љ–µ–њ–Њ–ї—П—А–љ–Њ–є. –Ф–ї–Є–љ–∞ —Б–≤—П–Ј–Є CвАУC –≤ –њ—А–µ–і–µ–ї—М–љ—Л—Е —Г–≥–ї–µ–≤–Њ–і–Њ—А–Њ–і–∞—Е —А–∞–≤–љ–∞ 0,154 –љ–Љ. –°–≤—П–Ј—М –°вАУ–Э — –Ї–Њ–≤–∞–ї–µ–љ—В–љ–∞—П —Б–ї–∞–±–Њ–њ–Њ–ї—П—А–љ–∞—П, —В.–Ї. —Г–≥–ї–µ—А–Њ–і –Є –≤–Њ–і–Њ—А–Њ–і –±–ї–Є–Ј–Ї–Є –њ–Њ —Н–ї–µ–Ї—В—А–Њ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ—Б—В–Є (2.5 — –і–ї—П —Г–≥–ї–µ—А–Њ–і–∞ –Є 2.1 — –і–ї—П –≤–Њ–і–Њ—А–Њ–і–∞). –°–≤—П–Ј–Є CвАУ–Э –љ–µ–Љ–љ–Њ–≥–Њ –Ї–Њ—А–Њ—З–µ. –≠–ї–µ–Ї—В—А–Њ–љ–љ–∞—П –њ–ї–Њ—В–љ–Њ—Б—В—М –љ–µ–Љ–љ–Њ–≥–Њ —Б–Љ–µ—Й–µ–љ–∞ –≤ —Б—В–Њ—А–Њ–љ—Г –±–Њ–ї–µ–µ —Н–ї–µ–Ї—В—А–Њ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞—В–Њ–Љ–∞ —Г–≥–ї–µ—А–Њ–і–∞.
–°—В—А—Г–Ї—В—Г—А–љ—Л–µ —Д–Њ—А–Љ—Г–ї—Л –Њ—В—А–∞–ґ–∞—О—В —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ —Б—В—А–Њ–µ–љ–Є–µ, –љ–Њ –љ–µ –і–∞—О—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–Љ —Б—В—А–Њ–µ–љ–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї, –Ї–Њ—В–Њ—А–Њ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ —Б–≤–Њ–є—Б—В–≤–∞ –≤–µ—Й–µ—Б—В–≤–∞.
–Я—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–µ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –∞—В–Њ–Љ–љ—Л—Е –Њ—А–±–Є—В–∞–ї–µ–є —Г–≥–ї–µ—А–Њ–і–∞ –Ј–∞–≤–Є—Б–Є—В –Њ—В —В–Є–њ–∞ –µ–≥–Њ –≥–Є–±—А–Є–і–Є–Ј–∞—Ж–Є–Є. –Т—Б–µ –∞—В–Њ–Љ—Л —Г–≥–ї–µ—А–Њ–і–∞ –≤ –Љ–Њ–ї–µ–Ї—Г–ї–∞—Е –∞–ї–Ї–∞–љ–Њ–≤ –љ–∞—Е–Њ–і—П—В—Б—П –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є s—А3-–≥–Є–±—А–Є–і–Є–Ј–∞—Ж–Є–Є.
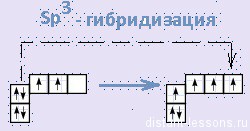
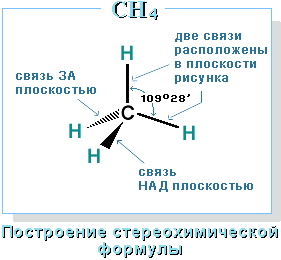
–≠—В–Њ –Њ–Ј–љ–∞—З–∞–µ—В, —З—В–Њ –≤—Б–µ —З–µ—В—Л—А–µ –≥–Є–±—А–Є–і–љ—Л–µ –Њ—А–±–Є—В–∞–ї–Є –∞—В–Њ–Љ–∞ —Г–≥–ї–µ—А–Њ–і–∞ –Њ–і–Є–љ–∞–Ї–Њ–≤—Л –њ–Њ —Д–Њ—А–Љ–µ, —Н–љ–µ—А–≥–Є–Є –Є –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –≤ —Г–≥–ї—Л —А–∞–≤–љ–Њ—Б—В–Њ—А–Њ–љ–љ–µ–є —В—А–µ—Г–≥–Њ–ї—М–љ–Њ–є –њ–Є—А–∞–Љ–Є–і—Л вАУ —В–µ—В—А–∞—Н–і—А–∞. –£–≥–ї—Л –Љ–µ–ґ–і—Г –Њ—А–±–Є—В–∞–ї—П–Љ–Є —А–∞–≤–љ—Л 109028 є. –Р—В–Њ–Љ —Г–≥–ї–µ—А–Њ–і–∞ –≤ –Љ–Њ–ї–µ–Ї—Г–ї–µ –Љ–µ—В–∞–љ–∞ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ –≤ —Ж–µ–љ—В—А–µ —В–µ—В—А–∞—Н–і—А–∞, –∞—В–Њ–Љ—Л –≤–Њ–і–Њ—А–Њ–і–∞ вАУ –≤ –µ–≥–Њ –≤–µ—А—И–Є–љ–∞—Е.
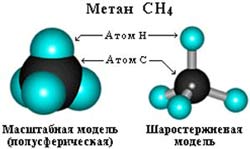
–°—В—А–Њ–µ–љ–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л –Љ–µ—В–∞–љ–∞ –°–Э4


–Я—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–µ —Б—В—А–Њ–µ–љ–Є–µ –Љ–µ—В–∞–љ–∞ –Љ–Њ–ґ–љ–Њ –њ–Њ–Ї–∞–Ј–∞—В—М —Б –њ–Њ–Љ–Њ—Й—М—О –Њ–±—К–µ–Љ–љ—Л—Е (–Љ–∞—Б—И—В–∞–±–љ—Л—Е) –Є —И–∞—А–Њ—Б—В–µ—А–ґ–љ–µ–≤—Л—Е –Љ–Њ–і–µ–ї–µ–є.
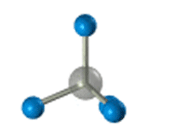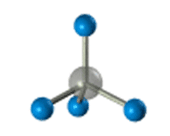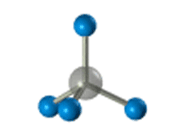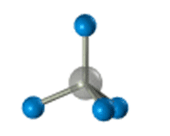
–Ф–ї—П –Ј–∞–њ–Є—Б–Є —Г–і–Њ–±–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ—Г—О (—Б—В–µ—А–µ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї—Г—О) —Д–Њ—А–Љ—Г–ї—Г.
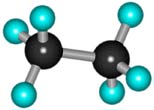
–°—В—А–Њ–µ–љ–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л —Н—В–∞–љ–∞ –°2–Э6
–Т –Љ–Њ–ї–µ–Ї—Г–ї–µ —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –≥–Њ–Љ–Њ–ї–Њ–≥–∞ вАУ —Н—В–∞–љ–∞ –°2–Э6 вАУ –і–≤–∞ —В–µ—В—А–∞—Н–і—А–Є—З–µ—Б–Ї–Є—Е sp3— –∞—В–Њ–Љ–∞ —Г–≥–ї–µ—А–Њ–і–∞ –Њ–±—А–∞–Ј—Г—О—В –±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Г—О –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ—Г—О –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—О:


–Ґ–∞–Ї –Ї–∞–Ї –≥–Є–±—А–Є–і–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л–µ –Њ–±–ї–∞–Ї–∞ –∞—В–Њ–Љ–Њ–≤ —Г–≥–ї–µ—А–Њ–і–∞ –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –Ї –≤–µ—А—И–Є–љ–∞–Љ —В–µ—В—А–∞—Н–і—А–∞, —В–Њ –њ—А–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї—Л –∞–ї–Ї–∞–љ–Њ–≤, —Б –±–Њ–ї—М—И–Є–Љ —З–Є—Б–ї–Њ–Љ –∞—В–Њ–Љ–Њ–≤ —Г–≥–ї–µ—А–Њ–і–∞, –Є–Љ–µ—О—В –Ј–Є–≥–Ј–∞–≥–Њ–Њ–±—А–∞–Ј–љ–Њ–µ —Б—В—А–Њ–µ–љ–Є–µ.
–°—В—А–Њ–µ–љ–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л –њ—А–Њ–њ–∞–љ–∞ –°3–Э8 вАУ —Ж–µ–њ—М –Ј–Є–≥–Ј–∞–≥–Њ–Њ–±—А–∞–Ј–љ–∞—П



–Ь–Њ–ї–µ–Ї—Г–ї–∞ –љ-–њ–µ–љ—В–∞–љ–∞
–Т—Б–µ —Б–≤—П–Ј–Є –≤ –Љ–Њ–ї–µ–Ї—Г–ї–∞—Е –њ—А–µ–і–µ–ї—М–љ—Л—Е —Г–≥–ї–µ–≤–Њ–і–Њ—А–Њ–і–∞—Е –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–µ. –Р—В–Њ–Љ —Г–≥–ї–µ—А–Њ–і–∞ –Њ–±—А–∞–Ј—Г–µ—В ѕГвАУ—Б–≤—П–Ј—М –Ј–∞ —Б—З–µ—В –њ–µ—А–µ–Ї—А—Л–≤–∞–љ–Є—П –≥–Є–±—А–Є–і–љ—Л—Е –Њ—А–±–Є—В–∞–ї–µ–є —Б –≥–Є–±—А–Є–і–љ—Л–Љ–Є –Њ—А–±–Є—В–∞–ї—П–Љ–Є –і—А—Г–≥–Њ–≥–Њ –∞—В–Њ–Љ–∞. –Я–µ—А–µ–Ї—А—Л–≤–∞–љ–Є–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —З—В–Њ –Њ–±–ї–∞—Б—В—М –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є —Б–Њ—Б—А–µ–і–Њ—В–∞—З–Є–≤–∞–µ—В—Б—П –≤ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ –љ–∞ –њ—А—П–Љ–Њ–є, —Б–Њ–µ–і–Є–љ—П—О—Й–µ–є —П–і—А–∞ –∞—В–Њ–Љ–Њ–≤. –Ґ–∞–Ї–Њ–µ –њ–µ—А–µ–Ї—А—Л–≤–∞–љ–Є–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ, –∞ –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–µ –њ—А–Є —Н—В–Њ–Љ ѕГвАУ—Б–≤—П–Ј–Є вАУ –љ–∞–Є–±–Њ–ї–µ–µ –њ—А–Њ—З–љ—Л–Љ–Є.

–Р–ї–Ї–∞–љ—Л (–њ—А–µ–і–µ–ї—М–љ—Л–µ —Г–≥–ї–µ–≤–Њ–і–Њ—А–Њ–і—Л)

 –†—Г–±—А–Є–Ї–Є:
–†—Г–±—А–Є–Ї–Є:  –Ґ–µ–≥–Є:
–Ґ–µ–≥–Є: 